Характеристики адсорбентов
Адсорбенты — пористые твёрдые вещества с сильно развитой поверхностью пор. Удельная поверхность пор может составлять от 200 до 1000 м2/г, а средний радиус пор от 0,2 до 10 нм. Адсорбенты применяют в виде таблеток, гранул или шариков размером от 2 до 6 мм, а также порошков размером от 20 до 500 мкм. В качестве адсорбентов используют активированный уголь, алюмосиликаты, цеолиты и др. Цеолиты (молекулярные сита) — природные и синтетические адсорбенты с регулируемым размером пор, представляющий собой алюмосиликаты натрия и калия. Синтетические адсорбенты активнее, но значительно дороже природных.
Важной характеристикой адсорбентов является их активность, под которой понимают массу адсорбированного вещества на единицу массы адсорбента в условиях равновесия. По отношению к разным компонентам смеси активность адсорбента различна. Так, парафиновые и нафтеновые углеводороды поглощаются в меньшей степени, чем ароматические, непредельные и гетеро атомные углеводороды (содержащие атомы S, N и O). С увеличением размера молекул адсорбата (молекулярной массы) адсорбционная способность адсорбента возрастает.
Адсорбенты характеризуются также временем защитного действия, под которым понимают промежуток времени, в течение которого концентрация поглощаемых компонентов на выходе из слоя адсорбента не изменяется. При большем времени работы адсорбента не изменяется. При большем времени работы адсорбента происходит проскок поглощаемых компонентов, связанный с исчерпанием активности адсорбента. В этом случае необходима регенерация адсорбента.
Активированные угли являются наиболее распространенными адсорбентами в водоподготовке. Они представляют собой пористые углеродные тела, зернённые или порошкообразные, имеющие большую площадь поверхности. Неоднородная масса, состоящая из кристаллитов графита и аморфного углерода, определяет пористую структуру активированных углей, а также их адсорбционные и физико-механические свойства. Активированные угли обладают высокой сорбционной активностью по отношению к основным классам загрязнителей воды: фенолам, нефтепродуктам, пестицидам, поверхностно-активным веществам (ПАВ). Пористая структура активированных углей характеризуется наличием развитой системы пор, которые классифицируются по размерам:
- микропоры (размер до 0,002 мкм);
- мезопоры (размер 0,002-0,05 мкм);
- макропоры (размер более 0,05 мкм).
Важной характеристикой адсорбентов является их активность, под которой понимают массу адсорбированного вещества на единицу массы адсорбента в условиях равновесия. По отношению к разным компонентам смеси активность адсорбента различна
Микропоры — наиболее мелкая разновидность пор, соизмеримая с размерами адсорбируемых молекул. Удельная площадь поверхности микропор достигает 800-1000 м2/г.
Мезопоры — поры, для которых характерно послойное заполнение поверхности адсорбируемыми молекулами, завершающееся их наполнением по механизму капиллярной конденсации. Удельная площадь поверхности мезопор достигает 100-200 м2/г.
Макропоры — это самая крупная разновидность пор, удельная площадь поверхности которых обычно не превышает 0,2-0,5 м2/г. Макропоры в процессе сорбции не заполняются, но выполняют роль транспортных каналов для доставки вещества к поверхности адсорбирующих его пор.
Структура активированных углей представляет собой пакеты плоских слоев, образованных конденсированными гексагональными ароматическими кольцами атомов углерода. Размеры их плоскостей находятся в пределах от 1 до 3 нм. Ориентация отдельных плоскостей в кристаллитах углерода довольно часто нарушена, и отдельные слои беспорядочно сдвинуты друг относительно друга, не всегда сохраняя при этом взаимное параллельное расположение (зоны аморфного углерода).
Активированные угли изготавливают на древесной и каменноугольной основах, а также из полимерных волокон. Процесс их производства заключается в карбонизации твёрдых органических материалов с последующим окислением образовавшегося угля-сырца кислородом воздуха, водяным паром, оксидом углерода (IV) или другими активирующими реагентами при температуре 700-1000 °C. В процессе активации угля пары воды и диоксид углерода диффундируют в поры карбонизованного материала и вступают в реакции окисления. При этом наименее плотная часть материала зоны аморфного углерода окисляется до газообразных продуктов, в результате чего формируются поры молекулярных размеров с большой внутренней поверхностью.
Адсорбционные свойства активных углей определяются количеством стандартного вещества, сорбированного единицей массы угля при определённых условиях, а также временем защитного действия единицы объёма угля до полного его насыщения. В основном адсорбционные свойства углей определяются микропора- ми, составляющими до 90 % всей поверхности активного угля. На ней и протекают процессы адсорбции, в основе которых лежит взаимодействие энергетически ненасыщенных атомов углерода с молекулами сорбируемых веществ. Лучше сорбируются вещества в молекулярной форме, хуже — в ионной.
Способность органических веществ к сорбции возрастает в ряду: гликоли ← спирты ← кетоны ← сложные эфиры ← альдегиды ← недиссоциированные кислоты ← ароматические соединения [10]. Способность веществ к сорбции также возрастает с ростом молекулярной массы и температуры.
Для оценки качества зернённых активированных углей, используемых в качестве загрузки в различные типы адсорберов, важное значение также имеют их физико-механические характеристики: фракционный состав (зернение), насыпная плотность, механическая прочность.

При адсорбции из водных растворов извлекаются в основном молекулы органических веществ, а также коллоидные частицы и микровзвеси
По форме и размеру частиц активированные угли могут быть порошкообразными, зернёнными (дроблёными и гранулированными), а также волокнистыми. Порошкообразные имеют размер частиц менее 0,1 мм, зернённые — от 0,5 до 5 мм, волокнистые — диаметр менее 0,1 мм, а длину несколько сантиметров.
Отметим, что порошкообразные активные угли как раз и используют для очистки воды однократно на городских станциях водоподготовки, вводя их во время или после коагуляции.
Зернённые угли применяются для очистки воды фильтрации в аппаратах со сплошным слоем сорбента типа механического фильтра. В зависимости от типа угли могут регенерироваться острым паром и химическими реагентами. Однако из-за сложности организации такого процесса, больших потерь угля и невозможности полной его регенерации (только на 40-70 %) уголь используют однократно. Волокнистые активированные угли имеют наибольшую эффективную площадь поверхности и могут применяться в фильтрах специальной конструкции. Они нашли широкое применение в бытовых фильтрах.
Древесные угли характеризуются высокой удельной площадью (величиной до 1,8-2,0 см3/г), широким распределением пор по размерам и, как следствие, высокой ёмкостью. С другой стороны, они имеют низкую механическую прочность и удельную массу. В системах водоподготовки применяются, как правило, в бытовых и малогабаритных промышленных фильтрах.
Угли на каменноугольной основе имеют значительно лучшие гидравлические и механические характеристики, что позволяет применять их в адсорберах с неподвижным и движущимся слоем адсорбента любых габаритов.
Особую группу представляют новые для отечественного рынка импортные активированные угли, изготовленные из скорлупы кокосового ореха, например, угли 207C фирмы Sutcliffe Carbons (Великобритания). В них сочетаются высокая прочность, стабильный оптимальный гранулометрический состав, а также высокая ёмкость.
При адсорбции из водных растворов извлекаются в основном молекулы органических веществ, а также коллоидные частицы и микровзвеси. Хорошо сорбируются фенолы, полициклические ароматические углеводороды, нефтепродукты, хлор- и фосфорорганические соединения. Активированные угли также используются как катализаторы разложения находящихся в воде активного хлора и озона. Эти процессы могут совмещаться с сорбцией органических веществ, повышая её эффективность. Соли, находящиеся в ионном виде, практически не извлекаются.
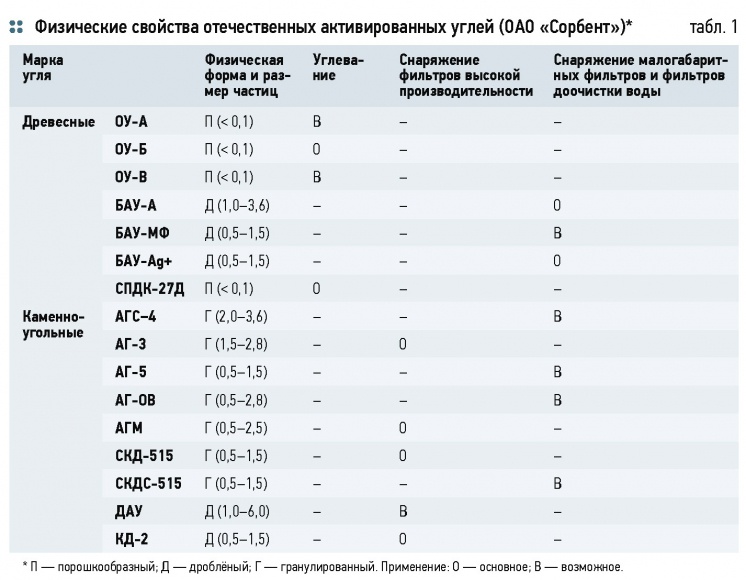
В табл. 1 приведены физические свойства и области применения отечественных активированных углей в отрасли водоподготовки.
Основной и наиважнейшей характеристикой, соответствующей каждой марке активированного угля, является суммарный объём микропор. Активированные угли адсорбируют органические вещества неприродного происхождения: фенолы, спирты, эфиры, кетоны, нефтепродукты, амины, ПАВ, органические красители, хлорамины [11]. Использование активированного угля позволяет на стадии глубокой очистки сточных вод снизить концентрацию органических соединений на 90-99 %.
При сорбции на активированный уголь не должна поступать вода, содержащая взвешенные и коллоидные вещества, забивающие поры активного угля. Использованный активированный уголь, исчерпавший свою сорбционную способность (ёмкость), регенерируется или полностью заменяется в установке.
Добавление окислителей (озона или хлора) перед подачей воды на угольные фильтры позволяет увеличить срок службы активированного угля до его замены, улучшить качество очищенной воды или проводить очистку от соединений азота. При совместном проведении сорбции и озонирования происходит синергетический эффект. Озон разрушает макромолекулы, а затем активированный уголь сорбирует продукты частичного разложения в полтора-три раза эффективнее, чем без предварительного окисления. Предполагается, что при этом происходит деструкция биологически трудноокисляемых соединений с образованием окисляемых, в результате чего на угольной загрузке протекают биологические процессы окисления органических веществ, в результате воздействия озона на макромолекулы их молекулярный вес и размеры уменьшаются, и они могут сорбироваться в истинных микро- порах активного угля.
Комбинация методов озонирования и сорбции позволяет снизить в два-пять раз расходы и озона и активного угля по сравнению только с сорбцией или только с озонированием, а, следовательно, и стоимость водоочистки.
При хлорировании воды с последующей сорбцией на активированном угле происходит удаление аммонийного азота. При хлорировании воды, содержащей аммонийный азот, в зависимости от рН, соотношения дозы активного хлора и концентрации аммонийного азота образуется смесь монохлораминов, дихлораминов, трёххлористого азота, сорбируемых при фильтрации активированным углем, и молекулярного азота, уходящего в атмосферу.
Цеолиты или молекулярные сита — синтетические или природные адсорбенты с регулярной структурой пор, представляющие собой алюмосиликаты натрия, калия или других элементов [12]. В промежутках кристаллического каркаса расположены гидратированные положительные ионы щелочных и щелочно-земельных металлов, компенсирующих заряд каркаса, и молекулы воды. Общая химическая формула цеолитов:
Ме2/n[(Аl2O3)x(SiO2)y]·Н2O
где Me — катион щелочного металла; n — его валентность.
В качестве катионов в состав природных цеолитов обычно входят натрий, калий, кальций, реже магний, барий, стронций. Кристаллическая структура цеолитов образована тетраэдрами SiO4 и АlO4.
Известно более 30-ти видов природных цеолитов, но лишь часть из них образует крупные месторождения (80 °% концентратов) удобные для промышленной переработки. Наиболее распространены природные цеолиты:
- шабазит — (Ca, Na2)[Al2Si4O12]·6H2O с размерами ячейки 0,37-0,50 нм;
- морденит — (Ca, Na2, K2)[Al2Si10O24]·7H2O с размерами ячейки 0,67-0,70 нм;
- клиноптиломит — (Na2, K2, Ca)[Al2O310SiO2]·8H2O с размерами ячейки от 0,75 до 0,82 нм.
Для получения прочных и водостойких фильтрующих материалов из природных цеолитов их, также как и глины, нагревают в печах с хлорид-карбонатом натрия при 1000 °C. Обработка поверхности цеолитов кремнийорганическими соединениями делает её гидрофобной, что улучшает сорбцию органических соединений и нефтепродуктов из воды.
При сорбции на активированный уголь не должна поступать вода, содержащая взвешенные и коллоидные вещества, забивающие поры активного угля. Использованный активированный уголь регенерируется или полностью заменяется
Синтетические цеолиты имеют строение и кристаллическую структуру, аналогичные природным цеолитам. Аналогами фожазита являются синтетические цеолиты типа X и Y: цеолиты типа А относятся к низкокремнистым формам — в них отношение SiO2:Al2O3 не превышает 2; цеолиты типа X имеют отношение SiO2:Al2O3, которое может изменяться от 2,2 до 3,3; цеолиты типа Y характеризуются соотношением SiO2:Al2O3 в пределах от 3,1 до 6.
Отметим, что при увеличении этого показателя повышается кислотостойкость цеолитов (размеры пор, определяющих избирательность цеолитов, изменяются от 0,0003 до 0,0009 мкм).
Благодаря свойству поглощать или пропускать через кристаллический каркас молекулы других химических соединений, цеолит может использоваться как своеобразное молекулярное сито для разделения смеси газов и жидкостей. Кроме этого цеолиты являются ионообменниками катионного типа, способными извлекать из воды тяжелые металлы, по сравнению с синтетическими смолами обладает повышенной избирательностью к ионам цезия, свинца, кадмия и стронция. Эффективны цеолиты и в отношении органических соединений, например, концентрация наиболее распространенного в воде канцерогена бензапирена уменьшается почти в 250 раз. Замена действующих кварцевых фильтрующих материалов на цеолит позволяет повысить производительность водоочистных сооружений почти в два раза.
Природные цеолиты используются в виде порошков и фильтрующих материалов для очистки воды от ПАВ, тяжелых металлов, ароматических органических соединений, красителей, пестицидов, коллоидных и бактериальных загрязнений. После использования цеолит подвергается многократной регенерации исходной водой или солевым раствором, в зависимости от конкретного целевого использования.
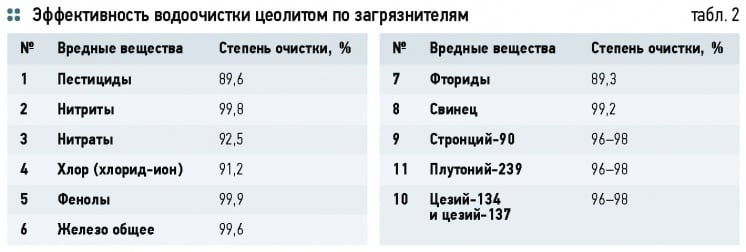
Эффективность водоочистки цеолитом по органическим и неорганическим загрязнителям показана в табл. 2.
Макропористые иониты имеют большую механическую прочность, но меньшую объёмную ёмкость, чем гелевые и изопористые. Они обладают высокой осмотической стабильностью, улучшенной кинетикой обмена, проявляют ситовый эффект
Иониты — класс фильтрующих ионообменных материалов на основе ионообменных смол, представляющие собой твёрдые, практически нерастворимые полиэлектролиты, природные, искусственные или синтетические, способные к ионному обмену. Как и цеолиты они состоят из каркаса (матрицы), несущего положительный или отрицательный заряд, и подвижных противоионов, которые компенсируют своими зарядами заряд каркаса и могут стехиометрически обмениваться на ионы того же заряда, содержащиеся в водном растворе.
Большинство органических ионитов, за исключением макропористых и изопористых ионитов, имеют гелевую структуру. В них отсутствуют реальные поры. Доступность всего объёма их зерен для обменивающихся ионов обеспечивается благодаря их способности к набуханию в водных растворах.
Многие катиониты, в том числе цеолиты (за исключением клиноптилолита, эрионита и морденита) и глинистые минералы, могут работать только в солевых формах (натриевой, кальциевой и т.д.). Они не могут быть переведены в водородную форму, так как при этом разрушается их структура, и, следовательно, не могут применяться в технологии обессоливания и опреснения сточных и природных вод. Кроме того, обессоливание воды невозможно без одновременного использования анионитов, которые среди неорганических минералов
и соединений встречаются весьма редко. Эти обстоятельства в немалой степени способствовали развитию синтеза органических катионитов и анионитов на основе синтетических органических соединений, получивших широкое применение в технологии обессоливания воды, в гидрометаллургии, в технологии очистки сточных вод и в других отраслях.
Большинство органических ионитов получают полимеризацией, поликонденсацией или путем полимераналогич- ных превращений (химической обработкой полимера, не обладавшего до этого свойствами ионита) сополимеров стирола и дивинилбензола (ДВБ). В их числе сильнокислотные катиониты (например, КУ-2-8), сильно- и слабоосновные аниониты (например, АВ-17-8). Направленный синтез ионообменных смол позволяет создавать материалы с заданными технологическими характеристиками. Успешно развивается синтез важных в практическом отношении ионитов на базе винильных производных пиридина, прежде всего 2,5-метилвинилпиридина, на основе алифатических соединений ионогенного характера, таких как метилакрилат, акрилонитрил, полиэтиленполиамины, эпихлоргидрин.
Макропористые иониты получаются путем введения в реакционную массу в процессе сополимеризации и поликонденсации порообразователя (изооктан, декан, бензины БР-1, БЛХ, спирты нормального и изомерного строения), после удаления, которого ионит сохраняет реальные поры и приобретает свойства адсорбентов типа активных углей: большую удельную поверхность и объём пор. Макропористые иониты имеют большую механическую прочность, но меньшую объёмную ёмкость, чем гелевые и изопористые. Они обладают высокой осмотической стабильностью, улучшенной кинетикой обмена, проявляют ситовый эффект.
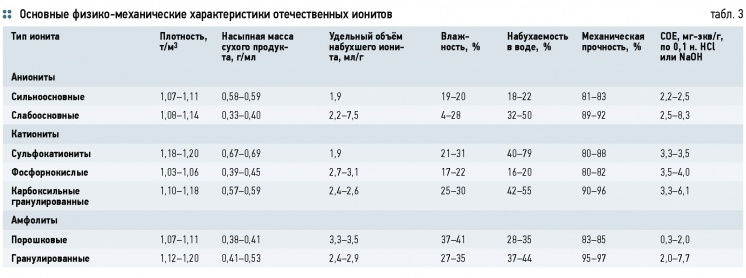
Основные физико-механические характеристики отечественных ионитов приведены в табл. 3.
Принципы расчёта адсорберов
Расчёт адсорберов периодического действия заключается в определении высоты слоя адсорбента, диаметра и высоты адсорбера. Количество адсорбента для поглощения адсорбтива из исходной смеси с начальной концентрацией ун до конечной ук определяется из материального баланса адсорбции:
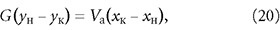
где G и Vа — масса газовой (жидкой) смеси и адсорбента, кг; хн и хк — концентрации адсорбтива и адсорбента, г/кг.
Принимая, что хн = 0, а хк → хр, получим следующее выражение:

или, если требуется определить конечное содержание адсорбтива в смеси:

Последнее уравнение представляет собой прямую с тангенсом угла наклона, равным tg(α) = –Vа/G в координатах у-х.
Диаметр адсорбера определяется в зависимости от расхода V [м3/с] парогазовой смеси или раствора через слой адсорбента и скорости потока v0 по формуле:

Высота слоя адсорбента:

где ρн — насыпная плотность адсорбента, кг/м3. Продолжительность адсорбции:
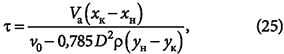
где ρ — плотность парогазовой смеси или раствора, кг/м3.
Высоту слоя адсорбента также можно найти на основании экспериментального определения времени защитного действия слоя или приняв его, исходя из технологических требований, по уравнению h = u(τ – τ0).
Скорость перемещения фронта адсорбции определяется уравнением:
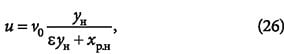
где v0 — фиктивная скорость потока, равная vкε (здесь vк — скорость потока в каналах между частицами адсорбента; ε — порозность слоя адсорбента); хр.н — концентрация адсорбтива в слое адсорбента, равновесная с объёмной концентрацией ун адсорбтива в потоке.
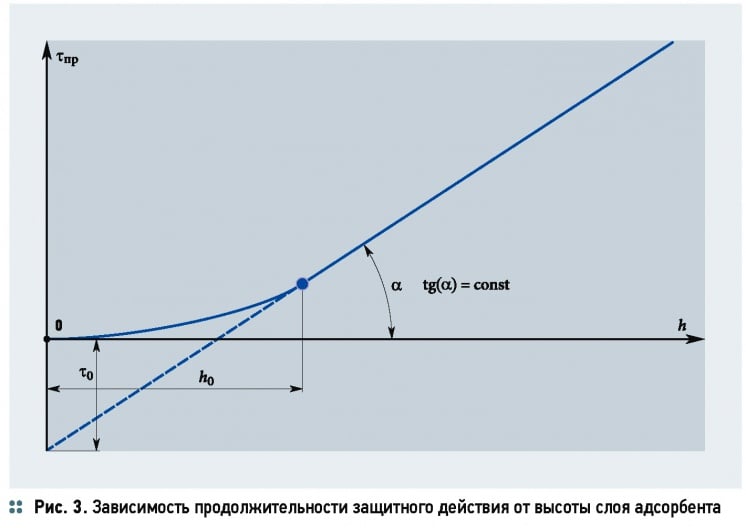
Потерю времени защитного действия слоя τ0 можно приближённо определить по уравнению:

где h0 — высота слоя адсорбента, м.
Затем, исходя из высоты слоя адсорбента и конструктивных соображений, определяют высоту адсорбера.
Расчёт адсорберов непрерывного действия заключается в определении высоты колонны, рабочего объёма, диаметра и числа тарелок.
Высоту адсорбера определяют по основному уравнению массопередачи:
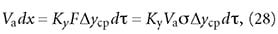
где Va — масса адсорбента в адсорбере, кг; σ — удельная площадь поверхности адсорбента в условиях проведения данного процесса, м2/кг. Тогда:

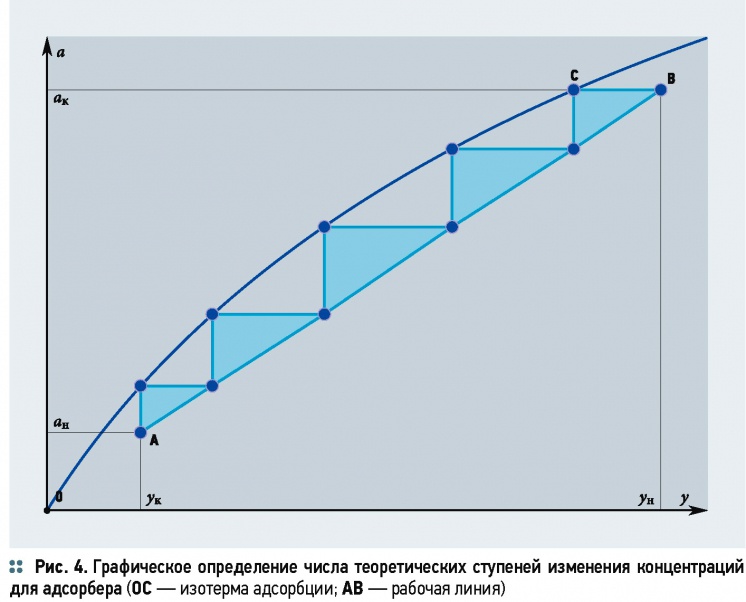
Расчёт числа теоретических тарелок может быть выполнен с использованием изотермы адсорбции и рабочей линии по аналогии с расчётом других массообменных процессов. Тогда их число определяется графическим построением ломаной линии между изотермой адсорбции и рабочей линией
Согласно уравнению материального баланса за промежуток τ в адсорбер поступает dL количества адсорбента и такое же количество отводится. При этом концентрация х изменяется на dx за счёт поступления свежего адсорбента:
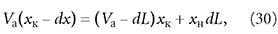
где хк — концентрация адсорбтива в адсорбенте, находящемся в адсорбере; L — расход адсорбента; хн — концентрация адсорбтива в поступающем в адсорбер адсорбенте. Из уравнения (30) получим:
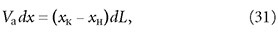
где dL = Ldτ. Отсюда:
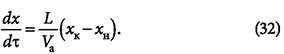
При хн = 0 получим:

Сравнивая уравнения (29) и (33), получим следующее выражение:

Отсюда получим рабочий объём адсорбера, который будет равен:

Время пребывания адсорбента в адсорбере с учётом, что τ = VaL:
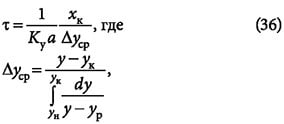
а ун и yк — начальная и конечная концентрации адсорбтива в газовой смеси; yp — равновесная концентрация.
Время защитного действия или адсорбции вычисляется как:
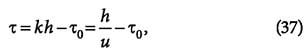
где k = 1/u — коэффициент защитного действия слоя; τ0 — потеря времени защитного действия слоя адсорбента.
Величины в уравнении (37) определяются на основании экспериментальных данных, которые изображаются в виде графика (рис. 3). Тангенс угла наклона прямолинейной части кривой равен коэффициенту защитного действия слоя tg(α) = k, а отрезок, отсекаемый на продолжении оси ординат, соответствует потере времени защитного действия τ0.
Диаметр адсорбера определяется по уравнению (23). Высота адсорбента в адсорбере вычисляется по формуле:

Число тарелок в тарельчатых адсорберах с псевдоожиженным слоем:

где hт — высота слоя адсорбента на тарелке (принимается равной 50 мм).
Расчёт числа теоретических тарелок может быть выполнен с использованием изотермы адсорбции и рабочей линии по аналогии с расчётом других массообменных процессов.
В этом случае число теоретических тарелок определяется графическим построением ломаной линии между изотермой адсорбции и рабочей линией (рис. 4). На основе такого построения производится определение общего числа теоретических тарелок в адсорбере.

Выводы
На основании вышесказанного можно сформулировать следующие закономерности процесса адсорбции.
1. Существуют различные математические модели адсорбции — мономолекулярная адсорбция, полимолекулярная адсорбция, капиллярная конденсация, каждая из которых описывает экспериментальные данные в определённых условиях.
2. Адсорбирующая способность веществ зависит от природы, строения молекул и молекулярного веса исходных веществ, а также от структуры адсорбента, величины удельной поверхности, размеров пор и химического состава.
3. Адсорбция является наиболее эффективной при малых концентрациях извлекаемых веществ. Чем меньше температура и больше давление при адсорбции, тем больше степень извлечения целевых компонентов.
4. При исчерпании адсорбционной способности возникает проскок адсорбата и необходимость регенерации адсорбента. Активность адсорбента от числа регенераций постепенно снижается. Наибольшее падение активности обычно наблюдается после первой регенерации.


























