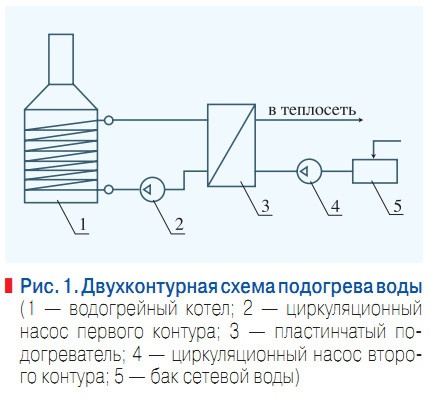
Рис. 1. Двухконтурная схема подогрева воды
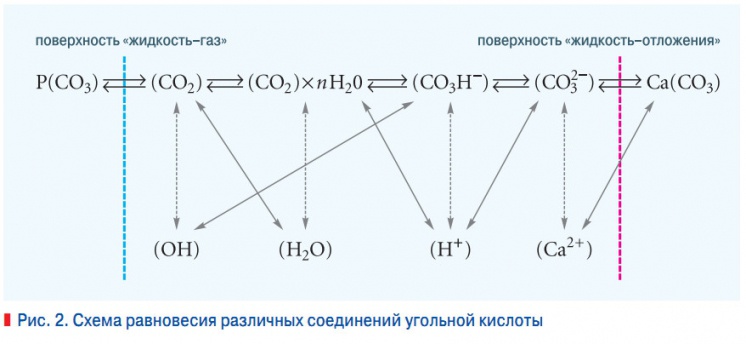
Рис. 2. Cхема равновесия различных соединений угольной кислоты
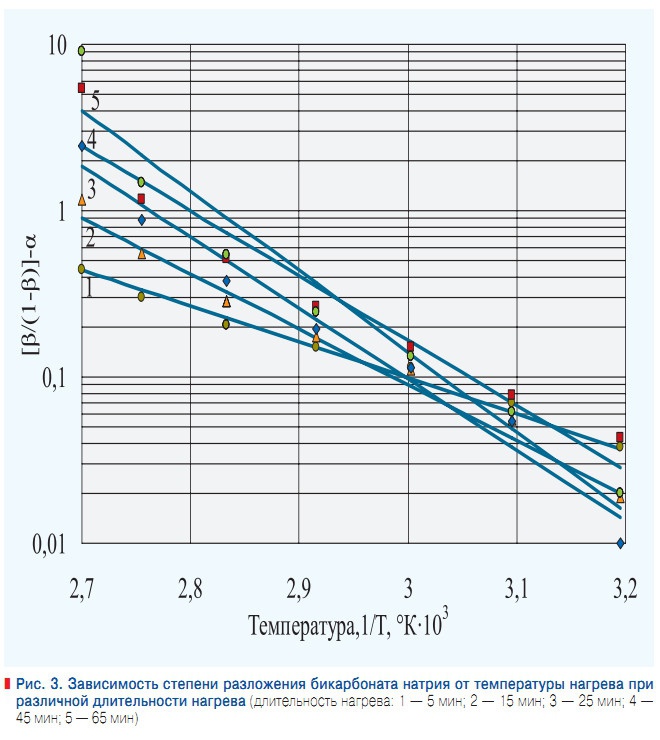
Рис. 3. Зависимость степени разложения бикарбоната натрия от температуры нагрева при различной длительности нагрева
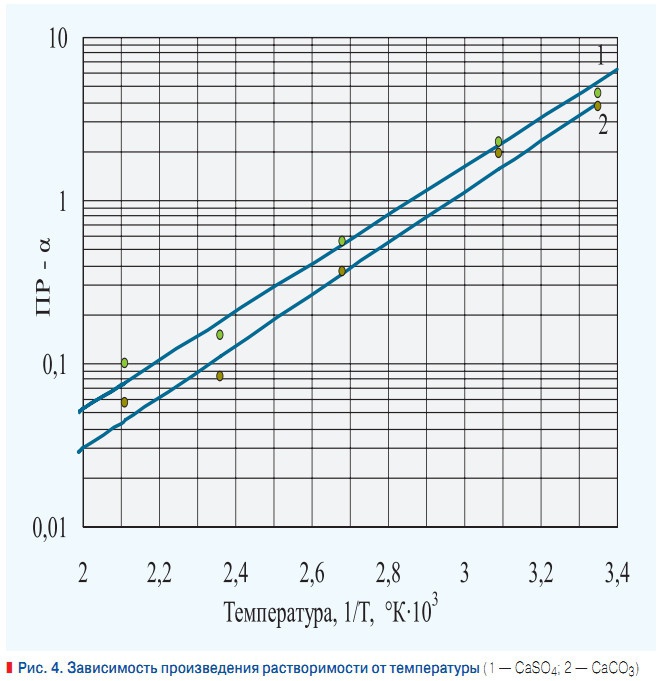
Рис. 4. Зависимость произведения растворимости от температуры
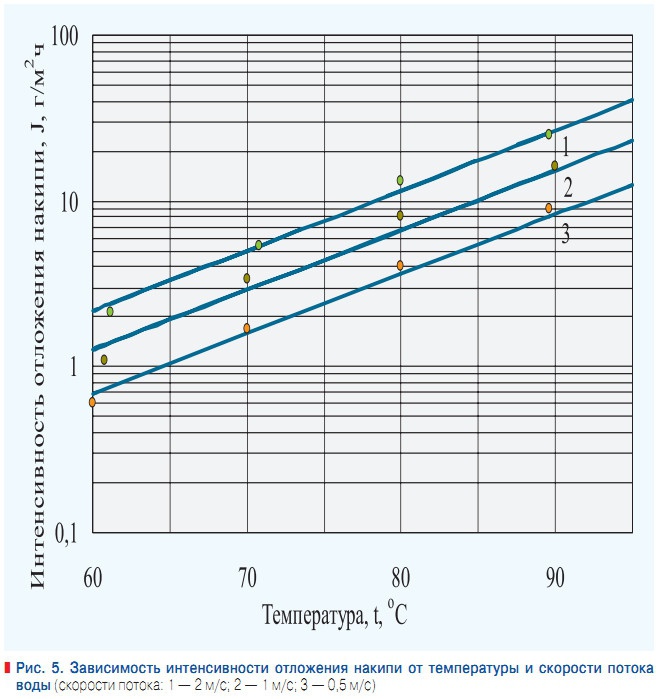
Рис. 5. Зависимость интенсивности отложения накипи от температуры и скорости потока воды
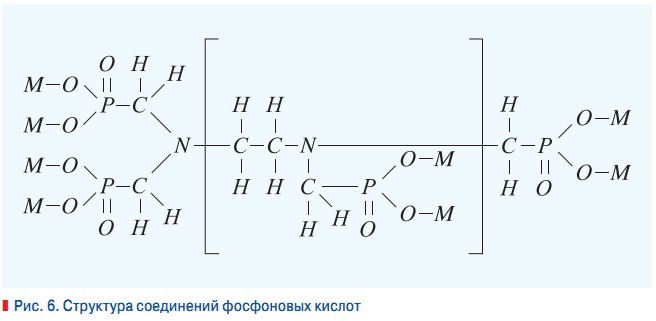
Рис. 6. Cтруктура соединений фосфоновых кислот
![Табл. 1. Произведения растворимости некоторых накипеобразователей [9, 10] Табл. 1. Произведения растворимости некоторых накипеобразователей [9, 10]](/images/articles/46772.jpg)
Табл. 1. Произведения растворимости некоторых накипеобразователей [9, 10]
При больших объемах очищаемой воды, составляющих несколько тысяч м3/ч, очистка воды представляет серьезную экологическую и техническую проблему. Так, при подготовке воды методом умягчения, при жесткости исходной воды 7 мг÷экв/л и расходе умягченной воды 1000 т/ч только расход поваренной соли на регенерацию фильтров составляет 29 т/сут. Примерно такое же количество засоленных стоков (в пересчете на твердые соли) поступает в поверхностные водоемы, вызывая их засоление.
Интенсивность накипеобразования на греющих поверхностях нагрева зависит от жесткости и щелочности очищенной воды в зоне нагрева. При щелочности нагреваемой воды 1,3–1,4 мг÷экв/л и продолжительности нагрева 40–60 с (характерной для водогрейных котлов) интенсивность накипеобразования при температуре подогрева до 130–150 °С столь значительна, что в течение отопительного сезона на каждом квадратном метре поверхности труб в котле отлагается около 2 кг отложений.
Для тех же температур и качества воды для сетевых подогревателей, в которых продолжительность нагрева не превышает 5 с, интенсивность отложений такова, что аналогичная масса отложений карбоната кальция (2 кг/м2) образуется после 6– 7-летнего периода эксплуатации. Учитывая изложенное, С.П. Высоцким для теплофикационных систем предлагается двухконтурная схема подогрева воды в водогрейных котлах и подогревателях [1].
При этой схеме подогрева, показанной на рис. 1, в первом контуре циркулирует хорошо очищенная до малой жесткости вода, а подпиточная вода во второй контур очищается до более низких кондиций. При этом, например, при подогреве сетевой воды до температуры 100 °С в водогрейных котлах карбонатный индекс подпиточной воды на должен превышать 2 (мг÷экв/кг)2, а при подогреве в сетевых подогревателях ≈ 3,4 (мг÷экв/кг)2.
При таких параметрах в 1,7–2,5 раза может быть ухудшено качество воды, в такое же количество раз уменьшена производительность водоподговительной установки или принята упрощенная технология очистки воды (например, методом подкисления). Учитывая весьма незначительные потери воды в первом контуре, применение двухконтурного подогрева воды и упрощенная технология обработки воды во втором контуре позволяет существенно снизить затраты на реагенты и уменьшить загрязнение окружающей среды.
В качестве подогревателей в системе подогрева воды были использованы пластинчатые подогреватели «Альфа Лаваль». Следует отметить, что при использовании систем очистки воды необходимо удалять из воды только те соединения, которые создают проблемы: накипеобразования, коррозии, гигиенические и др. При существующей схеме обработки воды методом умягчения исходной воды удаляется магний, который не создает каких-либо проблем с накипеобразованием.
Однако его удаление создает дополнительные экологические проблемы со сбором засоленных стоков. При умягчении совершенно не удаляются бикарбонат-ионы, которые создают коррозионные проблемы, а также увеличивают вероятность карбонат-кальциевого накипеобразования за счет возникновения карбонат-ионов при гидролизе бикарбоната натрия и проскоке ионов кальция в фильтрат. Влияние отдельных параметров на интенсивность накипеобразования было показано в [7].
Однако при этом требуется уточнение влияния степени гидролиза соединений гидрокарбонатов, механизмы процессов переноса к поверхностям нагрева и влияние изменения произведений растворимости карбоната кальция и гипса. В водном растворе устанавливается равновесие между тремя соединениями угольной кислоты СО2, СаСО3 и Са(НСО3)2 водородными и гидроксильными ионами.
В карбонатно-бикарбонатном равновесии можно рассматривать взаимодействие отдельных компонентов в трех фазах: 1 — газообразной, характеризуемой отдельным парциальным давлением СО2 в газах, контактирующих с жидкой фазой, 2 — жидкой, в которой СО2 абсорбируется с газовой фазы и карбонаты, растворяясь, переходят в жидкую фазу, 3 — твердой фазы, в которой происходит образование новых кристаллов карбоната кальция или растворение в результате описанных выше процессов.
Указанные равновесия можно представить схемой (рис. 2). Изменения в системе в результате перехода растворенной угольной кислоты в газовую фазу, например, при изменении температуры жидкости и парциального давления угольной кислоты в результате гидролиза бикарбонат-ионов сопровождается тремя ступенями перестройки системы:
- СО2 переходит из раствора в газовую фазу.
- Изменяется ионное равновесие в жидкой фазе, сопровождаемое изменением рН и концентрации карбонат-ионов. В результате произведения концентраций ионов кальция и карбонатов превышает произведение растворимости карбоната кальция.
- Происходит перенос вещества с жидкой фазы в твердую, в результате увеличивается размер уже образованных кристаллов или появляются новые кристаллы.
На интенсивность накипеобразования влияет концентрация карбонат ионов, появляющихся при гидролизе бикарбонат-ионов. Исследование изменения степени гидролиза бикарбоната натрия показало, что на степень гидролиза β влияет длительность нагрева воды и температура (рис. 3). Учитывая то, что процесс кристаллизации протекает из пересыщенных растворов с определенным индукционным периодом, очевидно, что время пребывания в зоне нагрева должно быть меньше индукционного периода. В [8] была найдена эмпирическая зависимость индукционного периода от активности ионов для гипса:
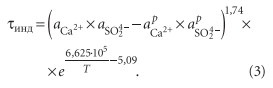
Обработка экспериментальных данных с применением Компертц-уравнения показала, что:
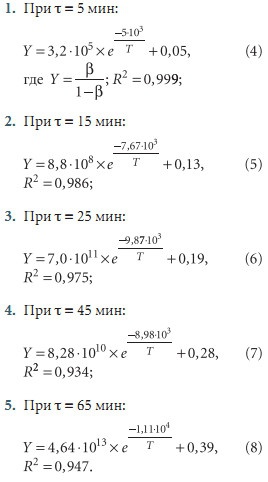
При подогреве исходной воды, поступающей в котлы и подогреватели, возможно возникновение различных видов накипей. При этом соединения будут осаждаться на поверхностях нагрева в определенной последовательности, которую можно выявить исходя из их произведений растворимости (табл. 1). Математическая обработка эксперементальных данных, для двух наиболее представительных с точки зрения накипеобразования солей карбоната кальция и сульфата кальция (ангидрита), позволила установить следующие зависимости произведений их растворимости от температуры (рис. 4):
1. для CaSO4:
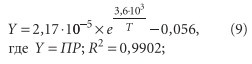
2. Для CaSO3:
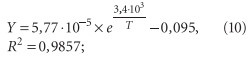
Соотношение концентраций (формула) (формула) Ca2+, Mg2+ в растворе, при которых начинают откладываться соединения, указанные в таблице, характеризуется следующим.
1. Вероятность выпадения в осадок гипса при подогреве воды до 100 °С:
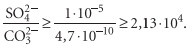
следовательно, гипс выпадет в осадок, если концентрация (формула) больше концентрации (формула) в 21300 раз.
2. Вероятность выпадения в осадок карбоната магния:
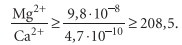
следовательно, карбонат магния выпадет в осадок, если концентрация Mg2+ больше концентрации Ca2+ в 208,5 раз.
3. Вероятность образования осадка гидроксида магния существует при подпитке систем теплоснабжения осветленной водой, прошедшей стадии известкования и фильтрации на механических фильтрах. При этом содержание гидроксил-ионов и карбонат-ионов в осветленной воде равны, соответственно, 0,2 и 0,6 мг÷экв/л (0,2 и 0,3 мг÷ион/л). Следовательно, опасность выпадения гидроксида магния на теплопередающих поверхностях появляется при концентрации магния:
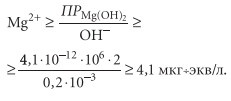
Получение такой концентрации магния после осветлителя в практических условиях почти невероятно. Поэтому для предотвращения выпадения гидроксида магния необходимо осуществлять обработку воды в осветлителе в бикарбонатном режиме с нульгидратной щелочностью воды или осуществлять подкисление воды. Кроме указанных факторов интенсивность накипеобразования зависит от температуры теплопередающей стенки и скорости жидкости.
Последняя определяет интенсивность доставки накипеобразователей к теплопередающей поверхности и время пребывания накипеобразователей в зоне нагрева. Мы составили математическую модель процесса накипеобразования и обработали экспериментальные данные, полученные во Всероссийском техническом институте и Московском энергетическом институте [7]. На рис. 5 показана зависимость интенсивности накипеобразования от скорости потока и температуры стенки. Эта зависимость выражается формулой:
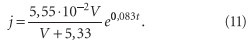
где V — скорость потока, м/с; t — температура стенки, °С. Коэффициент корреляции для 1 составляет R2 = 0,998, для 2 — R2 = 0,983, для 3 — R2 = 0,994. Таким образом, основным накипеобразующим компонентом в теплофикационных системах является карбонат кальция. Наибольшая опасность накипеобразования проявится при низких скоростях теплоносителя. При этом изменение температуры греющей стенки от 60 до 90 °С увеличивает интенсивность отложения солей примерно в 13 раз.
Для предотвращения накипеобразования в мировой практике начали широко применять определенные органические фосфорные соединения, использование которых в малых дозах может предотвратить отложение карбоната кальция на стенках трубопроводов [11, 12, 13]. Этими соединениями являются соли эминоэтиленфосфоновой кислоты. Аминоэтиленфосфонаты, более устойчивые к гидролизу по сравнению с полифосфатами, практически не образуют ионов фосфатов в воде.
Аминоэтиленфосфонаты имеют полимерную структуру и ингибируют образование отложений за счет порогового эффекта, увеличивая энергетический барьер реакции взаимодействия кальция и карбонат-ионов. Структуру соединений фосфоновых кислот можно представить в виде, представленным рис. 6. Индекс М представляет собой ионы водорода или металла или комбинацию этих катионов. При n = 0 структура представляет собой моноаминоэтиленфосфат, n = 1 — диаминоэтиленфосфонат и n = 2 — триаминоэтиленфосфонат.
Выводы
- Применение двухконтурных систем подогрева воды позволяет повысить надежность работы теплофикационных систем, сократить потребление реагентов на регенерацию фильтров и сбросы засоленных стоков в поверхностные водоемы.
- Применение традиционных систем подготовки воды для тепловых сетей методом умягчения в натрий-катионитных фильтрах сопряжено с потреблением значительного количества поваренной соли и сбросом больших объемов засоленных стоков в поверхностные водоемы.
- Использование технологии обработки воды в водород-катионитных фильтрах, загруженных слабокислотным катионом, позволяет существенно снизить потребление реагентов, объем сбрасываемых стоков и повысить надежность работы водоподготовительного оборудования.
- Рассмотрены основные факторы, влияющие на интенсивность накипеобразования при подогреве воды для тепловых сетей.
- Выведены уравнения, которые с высокой надежностью описывают изменение произведения растворимости карбоната кальция и ангидрита в зависимости от температуры теплоносителя, степень разложения бикарбоната натрия в зависимости от температуры и длительности нагрева, а также влияние температуры теплопередающей стенки и скорости потока на интенсивность отложения карбоната кальция.
























