В опубликованных ранее работах [1, 2] были рассмотрены химическое уравнение окисления двухвалентного железа до трёхвалентного, основанное на сочетании полуреакций окисления и восстановления, а также предельное отношение окисленного железа к восстановленному (глубина окисления), которое определяется условиями протекания реакции — рН, окислительно-восстановительным потенциалом, содержанием кислорода, минерализацией, температурой воды.
Уравнение окисления двухвалентного железа, по мнению автора, может быть представлено в виде
4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O. (1)
Для оценки отношения концентраций окисленного Fe3+ и восстановленного Fe2+ железа (глубины окисления) предложено выражение:
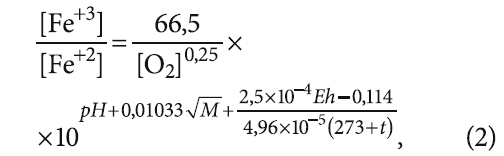
где [O2] — содержание растворённого в воде кислорода, мг/л; рН — водородный показатель; М — минерализация воды, мг/л; Eh — окислительно-восстановительный потенциал воды (ОВП), мВ; t — температура воды, °C; Fe2+ и Fe3+ в уравнении (2) подставляются применительно к размерности [мг/л].
Уравнение (2) позволяет определить предельную глубину окисления двухвалентного железа при данных показателях качества воды. Также в (2) перечислены граничные условия применения данной формулы: она применима при невысокой окисляемости воды и при минерализации не более 1000 мг/л, то есть для пресной воды.
Первое ограничение учитывает требование наличия Fe2+ и Fe3+ только в ионной форме, в то время как при высокой окисляемости они могут быть в составе комплексных железоорганических соединений. Возможно, имеется взаимосвязь между окисляемостью и значением окислительно-восстановительного потенциала Eh, что требует отдельного изучения. Второе ограничение связано с применимостью уравнения Дебая — Хюккеля, которое является упрощённой записью более общего уравнения электростатического взаимодействия между молекулами.
Выражение (2) показывает, что с увеличением рН, солесодержания М и Eh возрастает доля окисленного железа Fe3+, что действительно подтверждается опытом работы станций обезжелезивания. При этом Fe3+/Fe2+ снижается с увеличением содержания в воде кислорода, что может показаться нелогичным, так как аэрация является одним из условий эффективного обезжелезивания. Но, с другой стороны, с ростом концентраций исходных веществ реакции растёт её скорость, причём из трёх исходных веществ в реакции (2) при аэрации существенно увеличивается только [O2]. Как влияет аэрация на повышение Eh, должно быть темой для отдельного рассмотрения.
Результаты анализов воды, которые доступны автору (исходной и прошедшей сооружения станций водоподготовки), показывают следующий разброс значений (табл. 1). Данные получены по опыту работы станций безреагентного обезжелезивания подземных вод, включавших оборудование аэрации (безмасляные компрессоры, аэрационные колонны, сепараторы воздуха) и напорные фильтры, загруженные каталитически активной загрузкой. В этой же таблице показаны расчётные значения Fe3+/Fe2+ для исходной и очищенной воды. Минерализация воды во всех случаях составляла от 220 до 490 мг/л.

Представленные в табл. 1 данные следует считать скорее ориентировочными и оценочными, чем полными и достоверными, так как были получены по большей части (особенно Eh) с помощью ручных тестеров. Кроме того, далеко не всегда выдерживались требуемые ГОСТ правила отбора проб воды. Следует также обратить внимание на то, что анализируемое содержание кислорода может отличаться от реальных значений в аэрируемой воде, так как аэрация в напорных установках обезжелезивания происходит при давлении, в несколько раз превышающем атмосферное, а растворимость газов при повышенном давлении также возрастает согласно закону Генри — Дальтона.
Очевидно, что чем выше величина отношения Fe3+/Fe2+ (то есть во сколько раз содержание трёхвалентного железа превышает содержание двухвалентного) в очищенной воде по сравнению с исходной, тем эффективней протекает процесс обезжелезивания. Значение Fe3+/Fe2+ в очищенной воде менее 5–10 указывает на в целом низкую эффективность процесса при данных условиях.
Полученные в ходе анализов показатели качества исходной и очищенной воды (рН, Eh, [O2], М) позволяют проследить их влияние на Fe3+/Fe2+ согласно выражению (2).
Напомним, что схема обезжелезивания воды была безреагентной с использованием принудительной аэрации и напорных фильтров с каталитически активной загрузкой; несомненно, что и при других схемах обезжелезивания подобные расчёты также могут быть правомерны.
Значение рН воды мало изменялось при её обработке, следовательно не могло повлиять на повышение Fe3+/Fe2+ в очищенной воде по сравнению с исходной.
Содержание кислорода [O2] в очищенной воде возрастало максимум в 1,5–7,0 раз, что с учётом (2) не оказывало существенного влияния на Fe3+/Fe2+.
В отличие от рН и [O2] окислительно-восстановительный потенциал Eh в очищенной воде существенно возрастал, что, согласно (2), соответственно ведёт к значительному росту Fe3+/Fe2+. И неважно, используется ли повышения Eh кислород воздуха или более сильный окислитель.
Температура обрабатываемой воды за довольно короткое время нахождения в сооружениях водоподготовки измениться не может, поэтому почти никак не меняет отношение Fe3+/Fe2+ в исходной и очищенной воде.
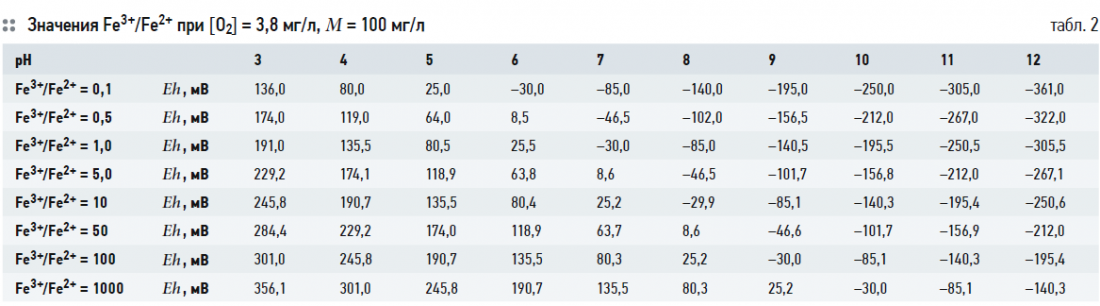
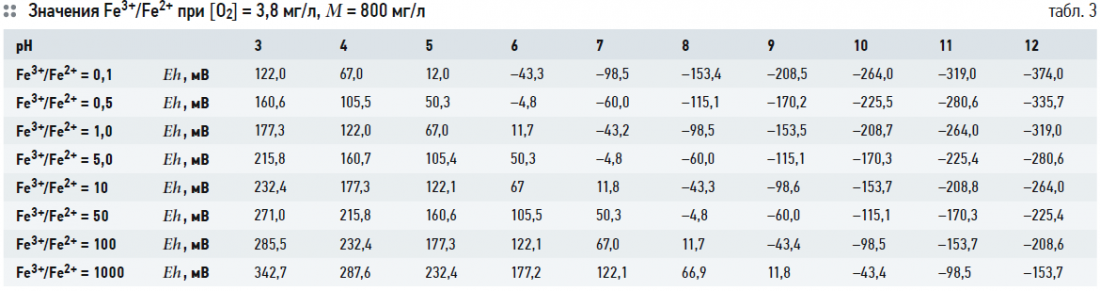
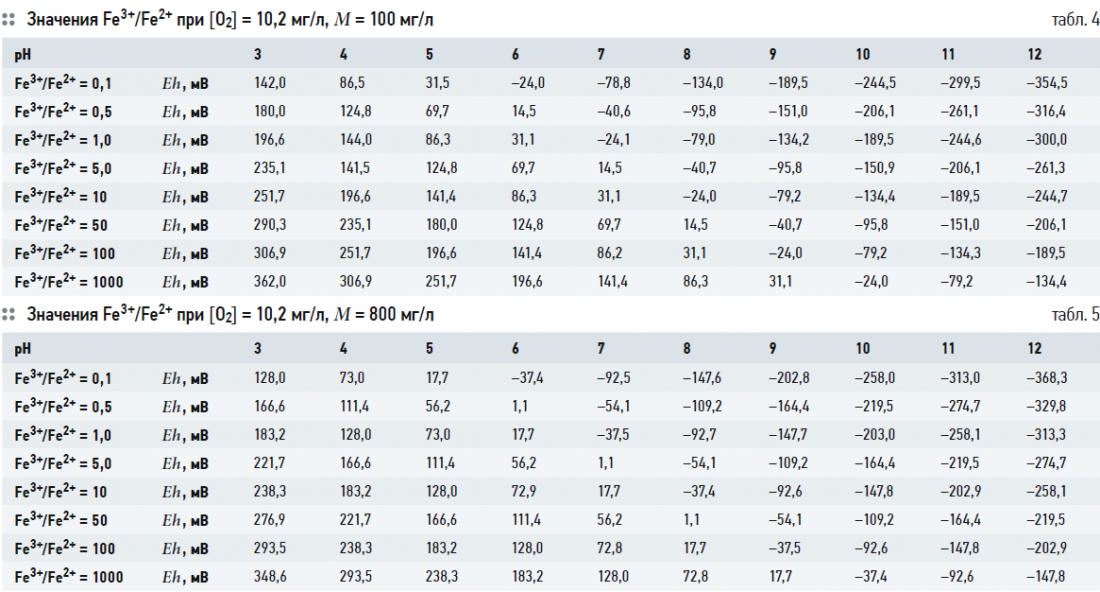
Выражение (2) связывает значения глубину окисления Fe3+/Fe2+ с рН и Eh при заданных [O2] и М. Термодинамически устойчивые формы существования железа в воде в зависимости от рН и Eh часто представляются в виде диаграммы Пурбе. В табл. 2–5 показаны расчётные значения Fe3+/Fe2+ при [O2] = 3,8 (30% от максимального насыщения при температуре 5°C) и 10,2 (80% от максимального насыщения при температуре 5°C) мг/л, при М = 100 и 800 мг/л и известных величинах рН и Eh. На рис. 1–4 показаны диаграммы Пурбе для железа с нанесёнными на них линиями постоянных значений Fe3+/Fe2+. Расчёты ограничивались значениями рН от 3 до 12.
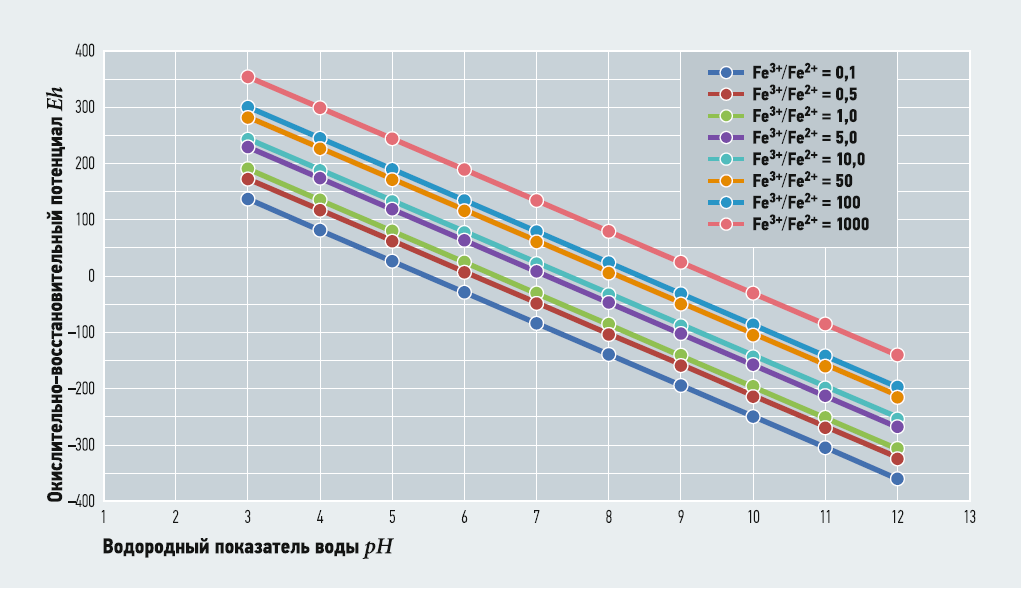
Рис. 1. Диаграмма Пурбе для железа (с линиями Fe3+/Fe2+ при [O2] = 3,8 мг/л, М = 100 мг/л)
Таким образом, графики глубины окисления Fe3+/Fe2+ при соответствующих рН и Eh представляют собой ряд параллельных отрезков, расположенных один над другим. Данные табл. 2–5 и рис. 1–4 также показывают, что содержание кислорода и минерализация (для пресных вод) не оказывают существенного влияния на величину Fe3+/Fe2+.
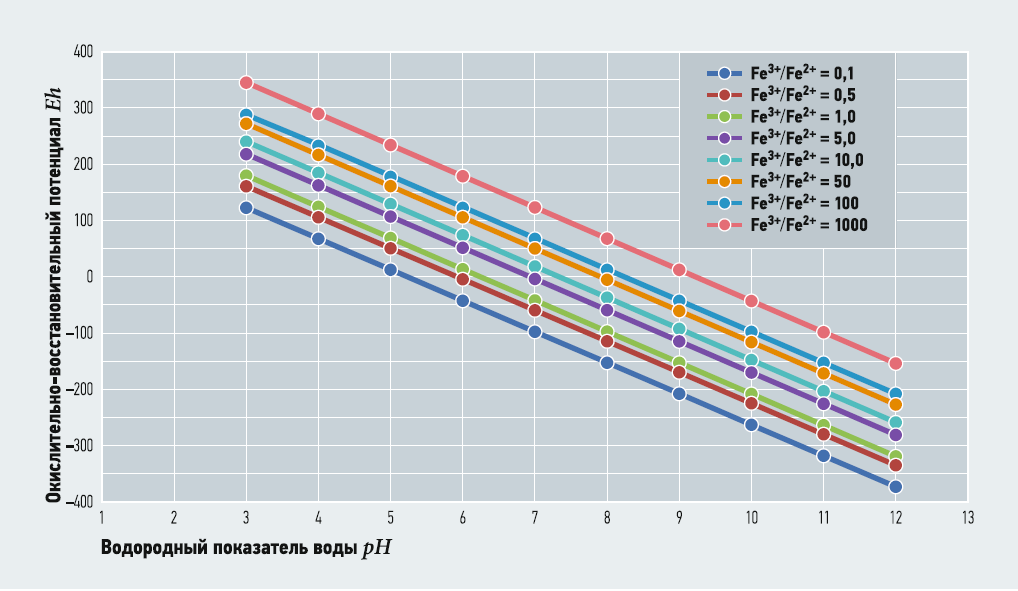
Рис. 2. Диаграмма Пурбе для железа (с линиями Fe3+/Fe2+ при [O2] = 3,8 мг/л, М = 800 мг/л)
В то же время при одном значении рН увеличение Eh приводит к резкому увеличению глубины окисления — практически по экспоненте, что указывает на ведущее значение ОВП для окисления двухвалентного железа.
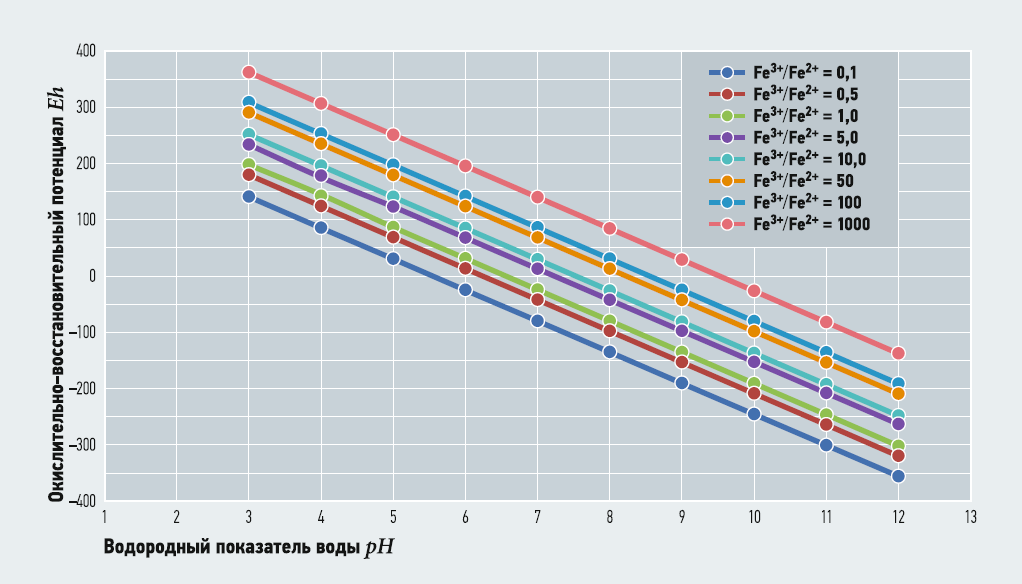
Рис. 3. Диаграмма Пурбе для железа (с линиями Fe3+/Fe2+ при [O2] = 10,2 мг/л, М = 100 мг/л)
Указанные графики позволяют прогнозировать глубину окисления двухвалентного железа для любых показателей качества воды с учётом ограничений по окисляемости и минерализации.
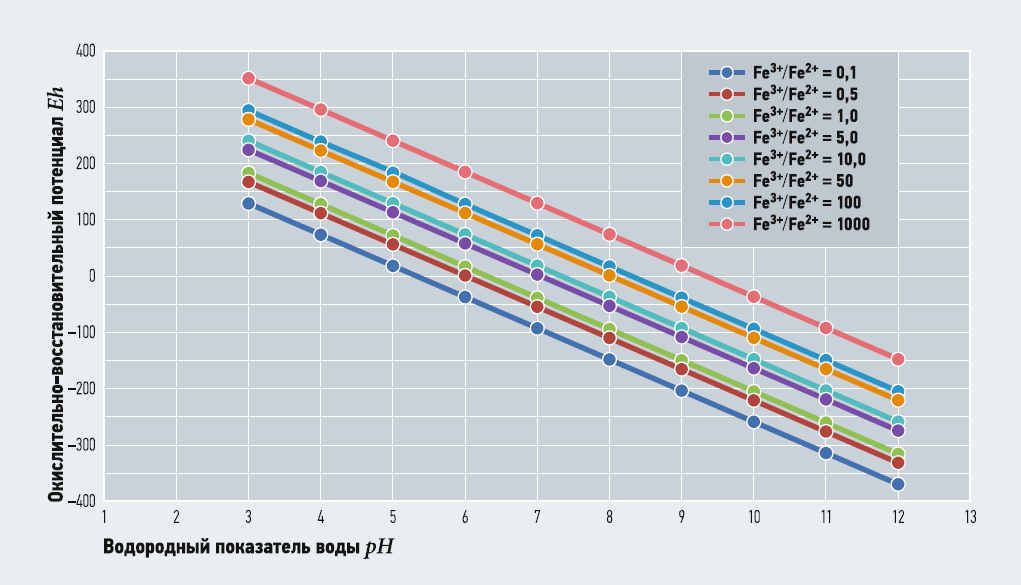
Рис. 4. Диаграмма Пурбе для железа (с линиями Fe3+/Fe2+ при [O2] = 10,2 мг/л, М = 800 мг/л)
То, что указанные отрезки попадают в область образования осадка Fe(OH)3, не должно смущать, так как процесс обезжелезивания не ограничивается только окислением двухвалентного железа. По-видимому, обезжелезивание включает, как минимум, две стадии: окисление двухвалентного железа и гидролиз с образованием малорастворимого осадка. Следовательно, некоторая часть трёхвалентного железа так и останется в негидрализованном состоянии.
Очевидно, что рост Eh и, соответственно, глубина окисления, зависят от устройства системы аэрации (упрощённая, принудительная с помощью эжектора или компрессора, на градирнях и т. д.) и от правильности работы этой системы. Предсказать величину роста Eh, по-видимому, невозможно на нынешнем уровне развития науки о водоподготовке.
В ходе работы был также поставлен вопрос, как изменяется Eh на отдельных этапах процесса обезжелезивания (в нашем случае — принудительная аэрация и напорная фильтрация). Здесь у автора не имеется подробного свода данных, кроме отдельных результатов измерений ОВП, которые показали, что Eh после аэрационных устройств возрастает на 10–20 мВ. Следовательно, основной вклад в окисление двухвалентного железа вносит фильтрующая загрузка, о которой стоит сказать пару слов.
В качестве фильтрующих загрузок на станциях обезжелезивания использовались каталитически активные зернистые материалы «Сорбент АС» и «Сорбент МС», которые считаются алюмосиликатными сорбентами (конечно, о сорбции в прямом смысле этого понятия здесь говорить можно только условно). Каталитически активные загрузки — достояние уже нового времени; ранее чаще всего использовались загрузки из химически нейтральных материалов типа кварцевого песка. Но и такие химически нейтральные загрузки вполне справлялись с задачей обезжелезивания воды (правда, при меньших скоростях фильтрации по сравнению с каталитически активными) за счёт образования на поверхности зёрен каталитической плёнки (слоя) из ранее выделившегося осадка.
В литературе можно встретить определение, что обезжелезивание в слое загрузки является гетерогенным автокаталитическим процессом, в ходе которого обеспечивается непрерывное обновление этой каталитической плёнки (хотя автор не встречал в литературе попыток детального рассмотрения данного явления, тем более с расчётами на количественном уровне). По-видимому, исследователи не углублялись в тонкости явления, ограничиваясь лишь прикладной задачей получения воды нужного качества. Впрочем, каталитически активные загрузки для эффективной работы также нуждаются в образовании упомянутого слоя на своей поверхности, хотя, возможно, в меньшей степени, чем песчаные загрузки. Данный процесс условно можно считать оксидированием — созданием оксидной плёнки (слоя) на какой-либо поверхности в результате окислительно-восстановительной реакции. Как говорят специалисты, должна произойти «зарядка загрузки». И опять же неясно, насколько проявляются каталитические свойства самой загрузки, а насколько окислительная способность определяется оксидной плёнкой.
Для образования данного слоя при пусконаладочных работах бывает целесообразно некоторое время дозировать в воду сильный окислитель — гипохлорит натрия — перед устройствами аэрации. Затем, после выхода фильтров на рабочий режим (каталитическая плёнка сформировалась, качество очищенной воды соответствует требуемому), дозирование можно отменить. Хотя согласно [3] требуется поддерживать содержание железа в очищенной воде менее 0,3 мг/л, но, по мнению автора, полноценно работающая станция обезжелезивания должна обеспечивать содержание железа в очищенной воде 0,15 мг/л и менее.
Поясним приведённые расчёты на примере. Предположим, что показатели качества исходной воды, добытой из скважины, следующие: Eh = −35 мВ, рН = 7,0, [O2] = 1,5 мг/л, М = 350 мг/л, температура воды — +5°C; содержание общего железа — Feобщ = 1,0 мг/л. Согласно (2) глубина окисления составит Fe3+/Fe2+ = 1,33.
Отсюда содержание двухвалентного железа равно Fe2+ = 0,43 мг/л, трёхвалентного — Fe3+ = 0,57 мг/л. Данные цифры показывают, что требуемого эффекта обезжелезивания при таких условиях не произойдёт даже при полной гидролизации трёхвалентного железа и образовании осадка.
После устройств аэрации минерализация и температура воды не изменились, значения других показателей составили: Eh = −20 мВ, рН = 7,1, [O2] = 2,5 мг/л. Теперь глубина окисления оценивается величиной Fe3+/Fe2+ = 2,77. Следовательно, Fe2+ = 0,27 мг/л, Fe3+ = 0,73 мг/л.
После напорных зернистых фильтров: Eh = +17 мВ, рН = 7,1, [O2] = 2,5 мг/л при постоянных [O2] и М. Отсюда следует, что Fe3+/Fe2+ = 12,97, Fe2+ = 0,072 мг/л, Fe3+ = 0,928 мг/л.
Таким образом, глубина окисления после напорных зернистых фильтров достаточна для снижения содержания железа заведомо ниже допустимого значения 0,3 мг/л. Разумеется, снизить содержание железа до таких значений можно только, используя стадию фильтрации после окисления. Следует также иметь в виду, что расчётная глубина окисления является предельной, которая может не быть достигнута при данных условиях, о чем следует поговорить отдельно.
Выводы
1. Глубина окисления двухвалентного железа до трёхвалентного Fe3+/Fe2+ прямо пропорциональна значению рН, окислительно-восстановительного потенциала (ОВП) Eh и обратно пропорциональна содержанию растворённого в воде кислорода [O2]; повышение температуры воды способствует увеличению глубины окисления, однако температура воды мало меняется в сооружениях водоподготовки.
2. Ведущую роль в окислении двухвалентного железа играет повышение Eh: с ростом ОВП Fe3+/Fe2+ возрастает практически экспоненциально.
3. Основную роль в повышении Eh в безреагентных системах обезжелезивания играет фильтрующая загрузка, а не устройства аэрации; при разработке станций водоподготовки подбор фильтрующей загрузки является определяющей задачей; предпочтение следует отдавать каталитически активным загрузкам, что не отменяет, впрочем, необходимость образования каталитической оксидной плёнки (слоя) на поверхности зёрен загрузки («зарядки загрузки»).
4. Для прогнозирования глубины окисления двухвалентного железа в воде можно использовать диаграмму Пурбе с нанесёнными на неё линиями одинаковых значений Fe3+/Fe2+ [согласно (2)] при известных значениях концентрации растворённого кислорода [O2] и минерализации М.
5. Необходимо продолжать изучение факторов, определяющих процесс обезжелезивания воды.

























