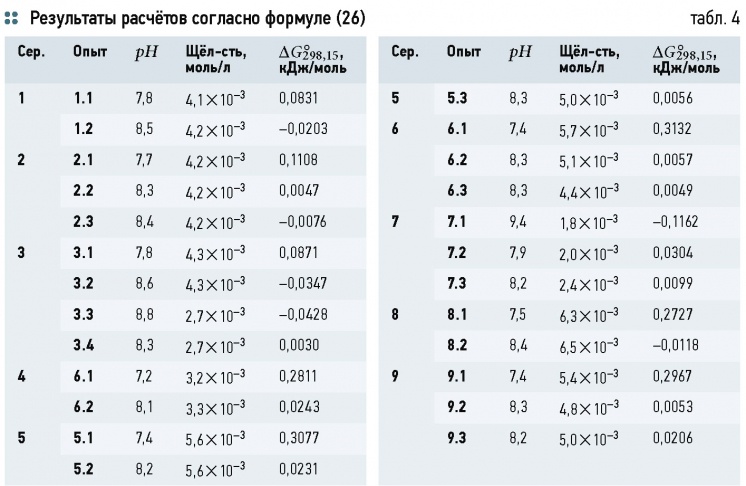
Теория буферных растворов позволяет, таким образом, рассматривать природные воды, в особенности подземные, как гидрокарбонатный буферный раствор, состояние которого определяется равновесием между растворённым углекислым газом CO2, гидрокарбонатами HCO-3 и карбонатами CO2-3 В этой системе наиболее подвержено изменению содержание CO2, так как оно напрямую связано с концентрацией углекислого газа в атмосфере и водоносных горных породах.
Обычно, говоря о процессе аэрации, подразумевают насыщение воды кислородом. Но через воду пропускают не чистый кислород, а воздух — смесь газов, состоящую в основном из азота (78,1 % по объёму), кислорода (20,9 %), углекислого газа (0,03 %). Поэтому точно также правомерно говорить о возможном насыщении воды и углекислым газом.
Если жидкость соприкасается со средой, представляющей собой смесь газов (такой, как воздух), то количество каждого из газов, которое растворится в данной жидкости, подчиняется закону Генри-Дальтона. Математически это можно записать как:

где α — коэффициент растворимости (коэффициент абсорбции) Бунзена, соответствующий объёму газа, физически растворяющегося в единице объёма жидкости при давлении 1 атм; sг — концентрация данного газа в газовой смеси; р — давление газовой смеси.
Произведение sгp является по сути парциальным давлением, то есть давлением, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный всему объёму смеси.
Коэффициент Бунзена α зависит от природы растворенного газа, свойств растворителя и температуры Т. Функцию α = f(T) для системы «вода-атмосферный углекислый газ» по опытным данным можно представить в виде полиномиальной зависимости
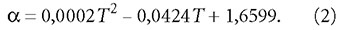
Выражение (2) применимо для чистой воды при температурах от 0 до 50 °C.
При 25 °C коэффициент Бунзена α для углекислого газа, вычисленный по формуле (2), составит 0,72. Следовательно, при атмосферном давлении равновесное содержание углекислого газа в одном литре воды будет 0,72 X 0,0003 = 0,00022 л/л. Так как объём одного моля любого газа при атмосферном давлении и температуре 25 °C (298 К) составляет около 24,4 л, то молярная равновесная (то есть соответствующая парциальному давлению) концентрация растворенного углекислого газа окажется равной 9,02 X 10-6 моль/л (0,40 мг/л). На данное явление — снижение концентрации углекислого газа до равновесной при аэрации — имеются многочисленные указания в специальной литературе, посвящённой декарбонизации воды.
При аэрации через воду пропускают не чистый кислород, а воздух — смесь газов, состоящую в основном из азота, кислорода и углекислого газа. Поэтому точно также правомерно говорить о возможном насыщении воды и углекислым газом
При этом авторы обычно указывают, что процесс удаления CO2 сложный и неоднозначный, вследствие чего редко удаётся снизить концентрацию углекислого газа менее 4-5 мг/л. Хотя основная причина наблюдаемого несоответствия очевидна: в отличие от простых газов (кислород, азот и т.п.) углекислый газ представляет собой оксид (диоксид углерода), способный вступать в химическую реакцию с водой с образованием кислоты, в данном случае угольной (H2CO3). Склонность H2CO3 к разложению на углекислый газ и воду не указывает на отсутствие химического взаимодействия с образованием продуктов диссоциации — гидрокарбонат- и карбонат-ионов.
Тут необходимо сделать несколько промежуточных выводов:
1. Широко распространённое в литературе понятие об отдувке углекислоты при аэрации не вполне правомерно, так как с физической точки зрения «отдуть» газ из жидкости невозможно; наблюдается только постепенное изменение содержания газа в воде вплоть до достижения равновесной концентрации, соответствующей парциальному давлению.
2. Становится понятным, почему аэрация является высокоэффективным методом удаления из воды таких газов, как сероводород H2S и метан CH4, — вследствие их ничтожного парциального давления в атмосфере.
3. Газообмен на границе «вода-воздух» — достаточно сложный и продолжительный процесс (рассмотрение его кинетики выходит за рамки данной статьи), что и вызывает необходимость разработки способов повышения его скорости и полноты протекания, от простейшего метода упрощённой аэрации до вакуумно-эжекционных установок.
4. Очевидно, что наиболее наилучший результат дегазации (в том числе и снижения концентрации CO2) может быть получен с помощью вакуумирования: исходя из выражения (1), чем ниже давление газовой смеси р, тем ниже равновесная концентрация газа в воде.
5. Влияние аэрации на углекислотное равновесие в воде нельзя рассматривать лишь в рамках физического воздействия — достижения равновесной (соответствующей парциальному давлению CO2 в атмосфере) концентрации CO2 в воде при интенсивном контакте с воздухом, так как диоксид углерода, кроме того, находится в динамическом равновесии с гидрокарбонат- и карбонат-ионами.
Влияние аэрации на углекислотное равновесие с точки зрения физических процессов нетрудно оценить с помощью уравнения Генри-Дальтона: если концентрация CO2 в воде выше равновесной 9,02 X 10-6 моль/л (при атмосферном давлении и температуре 25 °C), то в ходе аэрации она будет снижаться до достижения равновесия, если ниже — возрастать. Формула (2) позволяет рассчитать равновесную концентрацию для любого давления. Кроме того, известно, что растворимость газов снижается с увеличением солесодержания. В этом случае объём растворенного газа V`г по сравнению с объёмом V в выражении (1) можно оценить по формуле Сеченова:

где к — коэффициент Сеченова (высаливания), зависящий от природы газа и растворенной соли; Sэ — эквивалентная концентрация соли в растворе, моль/л.

Снижение растворимости CO2 вследствие минерализации в пресных природных водах незначительно. Если для углекислого газа и воды коэффициент k приближённо принять равным 0,89, то при соле содержании 500 мг/л (иными словами Sэ = 8,5 X 10-3 моль/л в пересчёте на NaCl) объём V`г составит около 0,98Vг. Поэтому для дальнейших расчётов равновесную концентрацию CO2 в воде примем равной 8,8 X 10-6 моль/л.
Оценить же влияние аэрации на углекислотное равновесие с точки зрения химических процессов — задача намного более сложная. Для её решения запишем сначала общее уравнение, связывающее все составляющие углекислотного буферного раствора (в первой части статьи это выражения (8), (9) и (11)]:
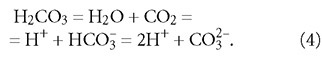
Отметим, что хотя в левой части уравнения вместо H2CO3 записано H2O + CO2, более обоснованным является рассмотрение процесса в качестве первой стадии диссоциации угольной кислоты, нежели в качестве реакции между углекислым газом и водой, что будет показано далее.
Из выражения (4) видно, что если концентрация CO2 выше равновесной, то при аэрации такой воды, согласно правилу Ле Шателье, равновесие сместится в сторону образования H2O и CO2 за счёт реакции между H+ и HCO-3.
Аналогичным образом уменьшаются концентрации веществ и в правой части уравнения. Результатом процесса в этом случае будет повышение рН и снижение щёлочности, обусловленной наличием в воде гидрокарбонат- и карбонат-ионов.
Наоборот, если концентрация CO2 ниже равновесной, то аэрация будет способствовать росту концентрации Н+, следовательно, и понижению рН. Увеличение щёлочности в этом случае если и возможно, то лишь при определённых условиях, что будет показано далее.
Аэрация является по сути внешним воздействием на систему. Но даже в отсутствии внешних воздействий химические реакции при нормальных условиях могут самопроизвольно происходить только в определённом направлении, что можно оценить с помощью законов химической термодинамики.
Согласно второму закону термодинамики самопроизвольный процесс в изолированной системе приводит к возрастанию энтропии этой системы и уменьшению свободной энергии Гиббса, что математически можно записать как:

где ΔG — свободная энергия Гиббса (термодинамический потенциал), то есть часть полной энергии системы, которая может быть превращена в работу, кДж/ моль; ΔН — энтальпия (сумма внутренней энергии и произведённой работы), кДж/моль; ΔS — энтропия (мера необратимого рассеивания энергии), кДж/ (моль-К); Т — абсолютная температура в Кельвинах.
Условием самопроизвольного течения химической реакции является значение ΔG < 0. Если ΔG > 0, то реакция самопроизвольно протекает в обратном направлении. При ΔG = 0 считается, что система пришла в равновесное состояние.
Рассчитать тепловой эффект реакции можно по закону Гесса, согласно которому тепловой эффект зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса и количества промежуточных реакций
Рассчитать тепловой эффект реакции можно, опираясь на закон Гесса, согласно которому тепловой эффект зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса и количества промежуточных реакций. Отсюда следует, что в изобарно-изотермических условиях (при неизменных давлении и температуре Т) изменения всех трёх величин — ΔG, ΔH и ΔS — будут равны:
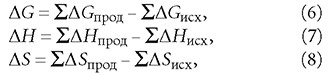
где ΣΔGпрод, ΣΔHпрод и ΣΔSпрод суммы энергии Гиббса, энтальпии и энтропии продуктов реакции в уравнениях химической реакции с учётом коэффициентов, соответствующих количеству моль вещества; ΣΔGисх, ΣΔHисх и ΣΔSисх - суммы энергии Гиббса, энтальпии и энтропии исходных веществ в уравнениях химической реакции с учётом коэффициентов, соответствующих количеству моль вещества.
Выражения (7) и (8) с учётом (5) можно представить в виде:
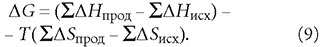
В справочной литературе обычно указывают значения стандартных энтальпий образования вещества ΔH°обр., стандартной энергии Гиббса образования ΔG°обр. и их стандартных энтропий S°. При «стандартных условиях» — давление атмосферное, температура 298,15 К (для практических расчётов можно принять 298 К, что соответствует 25 °C), поэтому соответствующие величины записывают как ΔH°обр.298,15, ΔG°обр.298,15 и ΔS°обр.298,15.
Строго говоря, стандартная энтропия S°298,15 и стандартная энтропия образования вещества ΔS°обр.298,15 — не одно и то же, однако подробное рассмотрение основ химической термодинамики не входит в задачу автора. В табл. 1 приведены необходимые исходные данные для последующих расчётов.
Изменение свободной энергии Гиббса реакции H2O + CO2 = H+ + HCO-3 согласно выражению (6) составит:
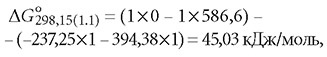
согласно выражению (9):
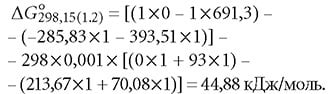
Изменение свободной энергии Гиббса реакции H2CO3 = H+ + HCO-3 согласно выражению (6) составит:
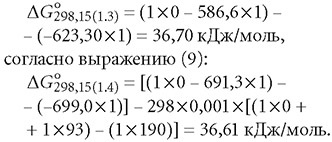
Во всех уравнениях коэффициент «1» соответствует количеству моль каждого вещества, участвующего в реакции.
Изменение свободной энергии Гиббса реакции H+ + HCO-3 = 2H+ + CO2-3 согласно выражению (6) составит:
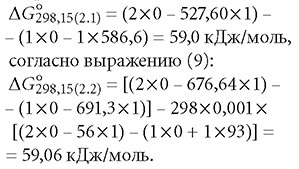
Кроме того, оценить значение свободной энергии Гиббса в зависимости от температуры и константы химического равновесия можно с помощью уравнения Вант-Гоффа:

где R — универсальная газовая постоянная, 8,31 Дж/(моль-К); Т — абсолютная температура, К; К — константа равновесия химической реакции.
Для стандартных условий
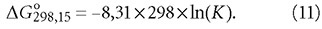
Так константа диссоциации является разновидностью константы химического равновесия, то для обеих стадий реакций

Сравнение полученных значений свободной энергии Гиббса по первой стадии реакции [ΔG°298,15(1.1)...ΔG°298,15(1.5)] (45,03; 44,88; 36,70; 36,61 и 36,22 кДж/ моль) показывает, во-первых, что данную стадию более правомерно рассматривать как диссоциацию угольной кислоты H2CO3 с ΔG°298,15 примерно 36-37 кДж/ моль, чем в как физический процесс растворения в воде углекислого газа. Во-вторых, химическая реакция самопроизвольно может идти только в сторону образования H2O и CO2 из ионов H+ и гидрокарбонат-ионов.
Сравнение значений свободной энергии Гиббса по второй стадии реакции [ΔG°298,15(2.1)...ΔG°298,15(2.3)] (59,0; 59,06 и 58,46 кДж/моль) указывает на самопроизвольное течение реакции в сторону образования гидрокарбонат-ионов.
Выше уже говорилось, что аэрация способствует снижению щёлочности. Термодинамические расчёты полностью подтверждаются тем фактом, что поверхностные воды, как правило, имеют небольшую щёлочность, которая снижается ещё больше в период паводков.
Обе стадии реакции происходят со снижением концентрации Н+, что соответствует повышению значения pH и даёт основание для общепринятого мнения о подщелачивании воды при аэрации. Однако очень редко можно встретить упоминание о том, что данный процесс имеет свои граничные условия.
В качестве доказательства можно привести уже упоминавшуюся кислую реакцию воды в градирнях, а также значение pH дождевой воды, которое обычно находится в пределах 5,5-6,0, несмотря на исключительно интенсивную аэрацию в атмосфере. Даже если концентрация растворенного CO2 превышает равновесную, значение pH не может возрастать до предельных значений, близких к 14. Такой вывод можно сделать, оценив выражения
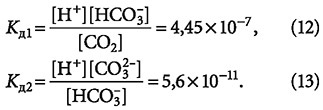
(в [1] они под теми же номерами.)
Очевидно, что при одном и том же значении [H+] отношение [HCO-3]/[CO2] на четыре порядка больше, чем [CO2-]/[HCO-3], то есть образование молекул углекислого газа из гидрокарбонат-ионов происходит интенсивнее образования самих ионов HCO-3 из HCO2-3. Иными словами, образование ионов HCO-3 является лимитирующей стадией процесса, что косвенно указывает на наличие некой точки равновесия. Похожие выводы можно сделать, анализируя выражения:
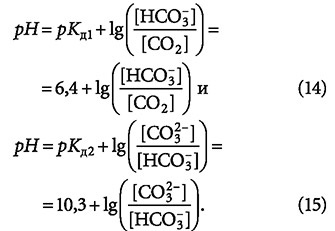
(в [1] они под теми же номерами.)
Если в уравнении (14) концентрация CO2 снижается быстрее, чем образуются ионы HCO-3, то это способствует росту рН выше 6,4. С другой стороны самопроизвольное течение реакции (15) в направлении CO2-3 → HCO-3 указывает на снижение рН менее 10,3. Итак, точка равновесия должна лежать между значениями рН = 6,4 и 10,3, а не смещаться в область высоких рН, хотя, на первый взгляд, это следует из (4). Такое предположение не противоречит второму закону термодинамики, так как, согласно теории буферных растворов, значение рН определяется соотношением компонентов раствора, а не наоборот. Хотя в статье не рассматривается термодинамика растворения углекислого газа в воде, но представляется очевидным, что достижение равновесной концентрации (соответствующей парциальному давлению в атмосфере) соответствует максимуму рассеяния (энтропии) и минимуму свободной энергии Гиббса.
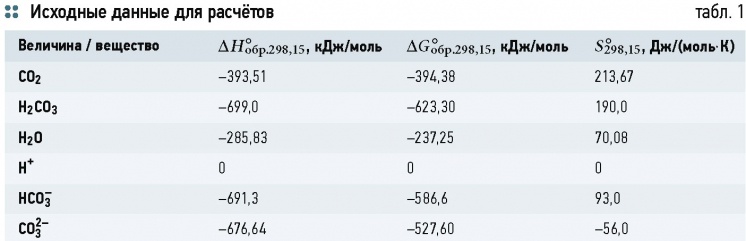
Значение равновесного рН для процесса аэрации (для стандартных условий: атмосферное давление и температура 25 °C) будет оценено далее с помощью термодинамических расчётов и экспериментальным путём. А пока выполним необходимые преобразования выражений (12) и (13). Из выражения (12) следует:
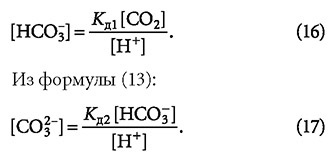
Так как щёлочность воды Щ [моль/л] определяется суммой ионов HCO-3 и CO2-3, то имеем:
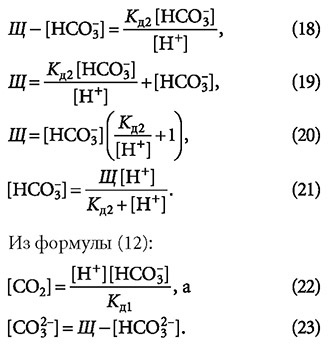
Таким образом, формулы (21), (22) и (23) позволяют рассчитать концентрации составляющих гидрокарбонатного буферного раствора по известным значениям щёлочности Щ и рН.
Экспериментальная часть работы состояла из серии опытов по аэрации проб воды из различных подземных источников Московской области. Аэрирование проводилось с помощью аквариумного микрокомпрессора производительностью 4 л/мин. Продолжительность аэрации — 1-6 ч. Условия проведения опытов по возможности устанавливались с расчётом максимально увеличить эффективность аэрации, например, с помощью использования узкой и высокой посуды, в которую наливались пробы воды и подавался воздух. Опыты проводились при комнатной температуре 20-25 °C.
Основными контролируемыми показателями были рН и щёлочность воды Щ. Также определялись жёсткость и содержание кальция, но эти данные не представлены в работе, как выходящие за её рамки. Определение показателей качества воды проводилось в аттестованной лаборатории. Результаты экспериментов приведены в табл. 2.
Данные в табл. 2 действительно показывают рост значения рН при аэрации исходной воды. Однако в опытах 3.3-3.4 и 7.1-7.3 (опыты с кипячёной водой), наоборот, наблюдалось снижение рН. После достижения в процессе аэрации рН = 8,28,4, происходила, как правило, стабилизация этого показателя. Среднее значение рН после аэрации в течение 1-6 ч оказалось равным 8,29. Тут следует оговориться, что даже современные средства измерения рН дают погрешность до 0,1, поэтому значение рН = 8,29, разумеется, нельзя считать достаточно точным, что не мешает увидеть общую тенденцию: значение рН не повышается при аэрации до экстремально высоких величин, а стремится к некой точке равновесия — примерно около 8,3.
Щёлочность воды в большинстве серий опытов существенно не изменялась. Снижение щёлочности наблюдалось в сериях 5, 6 и 9, а в серии 7, наоборот, наблюдалось заметное увеличение. Объяснение такого феномена выходит за рамки исследования, но, вероятно, связано с изменением индекса стабильности воды.
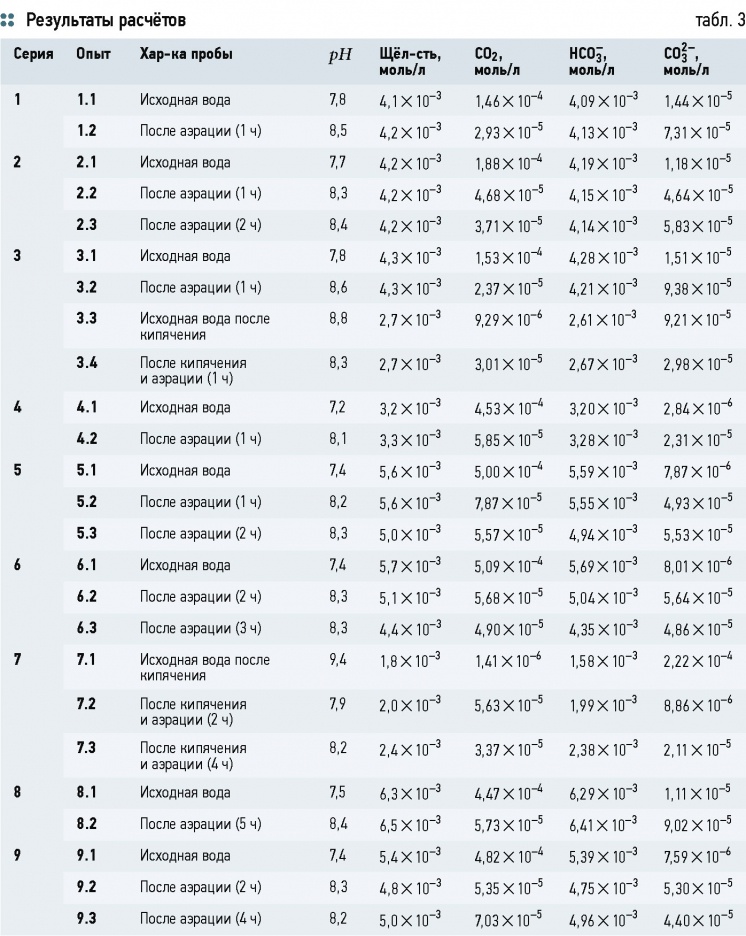
Выражения (21)-(23) позволяют для всех опытных данных оценить концентрации составляющих гидрокарбонатного буферного раствора. Результаты расчётов приведены в табл. 3.
Из табл. 3 видно, что практически во всех пробах (за исключением 7.1) содержание CO2 выше равновесного. Несмотря на это, в ряде опытов наблюдалось увеличение концентрации CO2 (хотя, согласно закону Генри-Дальтона, она должна падать), что сопутствовало снижению рН (опыты 3.3-3.4, 7.1-7.2, 9.2-9.3).
Наблюдался даже переход значений CO2 (опыты 7.1 и 7.2) через равновесное. Это является дополнительным указанием на то, что влияние химических реакций при аэрации преобладает над физическим процессом растворения и удаления углекислого газа.
Для теоретического обоснования полученных опытных данных и выдвинутых предположений будем использовать известные закономерности химической термодинамики.
Хотя выражение (6) было записано отдельно для двух стадий реакции, на самом деле составляющие буферного раствора образуют, разумеется, единую систему, которая стремится к равновесию, когда ΔG = 0.
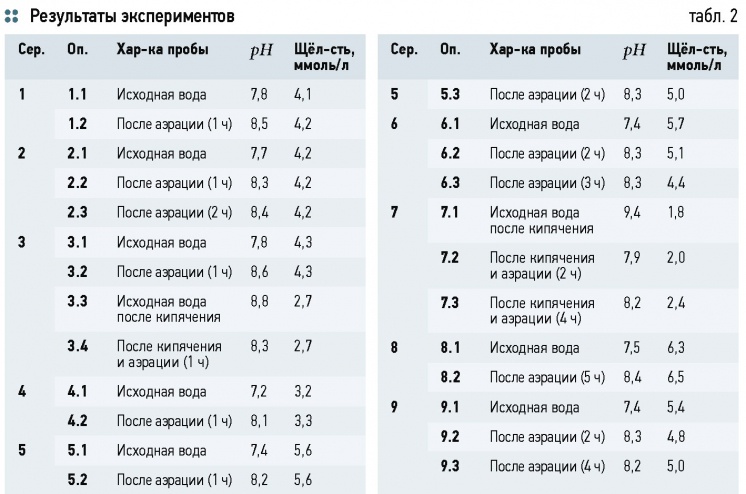
Запишем (4) в виде
H2CO3 = 2H+ + CO2–3. (24)
Для этой реакции рассчитаем свободную энергию Гиббса ΔG согласно выражениям (6), (9) и (11), причём в качестве константы химического равновесия в данном случае нужно принять произведение Кд1Кд2. Необходимые значения для H2CO3, CO2 и Н+ см. в табл. 1.
Тогда свободная энергия Гиббса для трёх указанных уравнений составит:
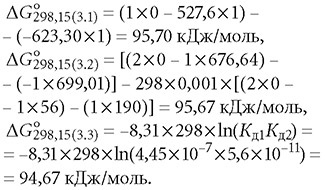
Близость данных полученных значений указывает на корректность проведённых термодинамических расчётов. Положительное значение ΔG°298,15 в данной реакции также подтверждает сделанные ранее выводы, что её самопроизвольное течение возможно лишь в сторону образования молекул H2CO3 → (H2O + CO2), и о преобладании химических взаимодействий над физическим процессом растворения углекислого газа в воде.
Несмотря на последнее утверждение (о преобладании химических взаимодействий над физическим процессом) представляется правомерным в уравнении (24) заменить H2CO3 на H2O + CO2, и
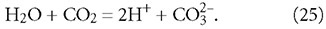
В выражении (25), как в уравнении любой химической реакции, стехиометрические коэффициенты каждого из соединений указывают на количество моль, участвующих в реакции. Стехиометрические коэффициенты учитываются и уравнениях химической термодинамики (6)-(9). Схожая размерность расчётных концентраций CO2, HCO-3 и CO2-3 [моль/л] позволяет сделать допущение о возможности подставить их вместо стехиометрических коэффициентов в уравнение (25). Так как изменение концентрации H2O в ходе реакции ничтожно по сравнению с общим количеством молекул воды, то исключаем H2O из рассмотрения. Поэтому выражение (6) с учётом (25) , данных табл. 1 и замены ΔG°обр.298,15(CO2) на ΔG°обр.298,15(H2CO3) запишется
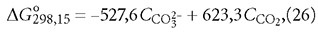
В табл. 4 представлены результаты расчётов согласно формуле (26) для полученных экспериментальных данных. Данные табл. 4 показывают, что ΔG°298,15 принимает как положительные, так и отрицательные значения, следовательно реакция в зависимости от условий может протекать, как в прямом, так и обратном направлении, то есть является обратимой. Чем меньше по модулю значения ΔG°298,15, тем система находится в более энергетически выгодном состоянии. Следует отметить также, что при одинаковых значениях рН энергия Гиббса тем меньше, чем меньше щёлочность воды. Аэрирование воды, как правило, приводит к уменьшению энергии Гиббса по модулю.
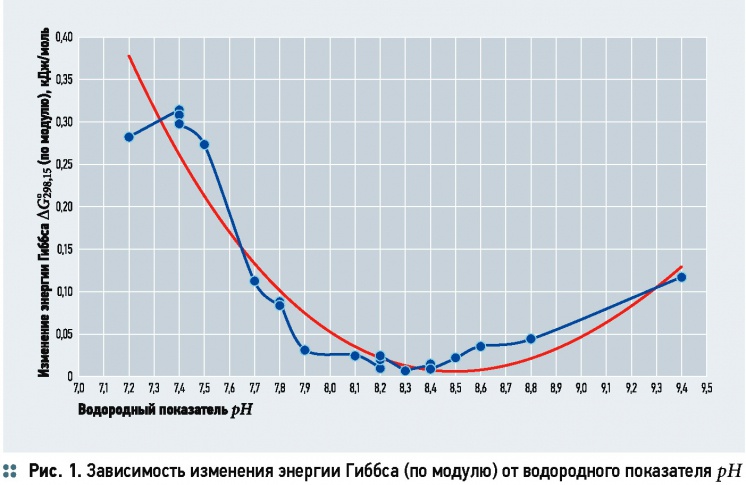
На рис. 1 представлена кривая изменения энергии Гиббса по модулю в зависимости от рН (с линией тренда). Хорошо заметен минимум значений ΔG°298,15 в области рН = 8,3-8,4. График в общих чертах повторяет кривую зависимости энергии Гиббса от состава реакционной смеси, на котором по оси абсцисс показывают концентрации исходных веществ и продуктов реакции.
Подбор значений рН (до третьего знака после запятой), соответствующих минимальному значению энергии Гиббса, даёт рН = 8,338 (ΔG°298,15 = -0,000011 кДж/ моль). При этом Щ = 5,0 X 10-3моль/л, [HCO-3] = 4,94 X 10-3, [CO2] = 5,10 X 10-5 и [CO2-3] = 6,02 X 10-5 моль/л. Как видно, содержание [CO2] выше равновесного.
В статье не рассматривается термодинамика растворения углекислого газа в воде с точки зрения закона Генри-Дальтона, хотя очевидна возможность проведения таких расчётов. Поэтому примем, что в ходе продолжительной интенсивной аэрации концентрация [CO2] постепенно станет равной 8,8 X 10-6 моль/л и ниже не опустится.
При таком значении [CO2] и неизменном рН = 8,338 параметры системы будут следующими: Щ = 0,86 X 10-3 моль/л, [HCO-3] = 8,50 X 10-4 моль/л, также [CO2-3] = 1,04 X 10-5 моль/л, ΔG°298,15 = -0,000002 кДж/моль. Падение значения ΔG°298,15 при этом почти на порядок указывает на самопроизвольное снижение щёлочности в процессе аэрации.
Расчётное значение рН в состоянии равновесия (8,338) хорошо согласуется с экспериментальными данными рН = 8,29. Также данная точка практически совпадает со значением рН, для которого в «классическом» графике углекислотного равновесия прилагается комментарий «при дальнейшем повышении рН (более 8,4) свободного СО2 в воде нет, а только гидрокарбонат- и карбонат-ионы».
С физической точки зрения влияние аэрации на углекислотное равновесие воды выражается в изменении концентрации углекислого газа в соответствии с законом Генри-Дальтона. А с химической точки зрения — аэрация проводит к смещению равновесия составляющих гидрокарбонатного буферного раствора
Выше было показано, что щёлочность воды при аэрации самопроизвольно может только уменьшаться. Это означает, что при нормальных условиях (давление — атмосферное, температура 25 °C), исходной щёлочности менее 0,86 X 10-3 моль/л и рН ниже 8,3, достижение равновесной точки невозможно. Например, при исходных Щ = 0,2 моль/л и рН = 6,5 в результате аэрации расчётное значение рН может повыситься только до 7,7 (при [CO2] около 8,9 X 10-6 моль/л).
При этом энергия Гиббса согласно (24), (25) и (26) составит ΔG°298,15 = 0,00528 кДж/моль, следовательно, в данном случае наблюдается обратная реакция и повышение щёлочности невозможно. Это объясняет, в частности, почему в градирнях охлаждаемая вода имеет как правило кислую реакцию.
Выводы
1. Влияние аэрации на углекислотное равновесие воды следует рассматривать как с физической, так и с химической точек зрения. С физической точки зрения оно выражается в изменении концентрации углекислого газа в соответствии с законом Генри-Дальтона, причём широко распространённый термин «отдувка углекислоты» следует считать не вполне корректным, так как изменение концентраций различных газов происходит независимо. С химической точки зрения аэрация проводит к смещению равновесия составляющих гидрокарбонатного буферного раствора.
2. Основным фактором, влияющим на значение рН при аэрации, является неравномерное течение двух стадий диссоциации угольной кислоты. Точкой равновесия для гидрокарбонатного буферного раствора является значение рН около 8,34, после достижения которой происходит постепенное снижение щёлочности воды до значения примерно 0,86 X 10-3 моль/л, что соответствует равновесной концентрации углекислого газа [CO2-3 = 8,8 X 10-6 моль/л (при атмосферном давлении и температуре 25 °C).
3. С помощью термодинамических расчётов показано, что химическая реакция в гидрокарбонатном буферном растворе самопроизвольно протекает в сторону образования угольной кислоты (углекислого газа) с уменьшением щёлочности, однако в частных случаях отмечается постоянство значения щёлочности или даже её увеличение, что связано, по-видимому, с изменением показателя стабильности воды, что требует дополнительных исследований. Процесс снижения щёлочности с помощью аэрации весьма продолжителен, что делает его практически бесполезным в реальных условиях.
4. Для изучения различных химических процессов, протекающих при водоподготовке, целесообразно и перспективно использование расчётных методик химической термодинамики.