Дефицит пресной воды остро ощущается на территории более 40 стран, расположенных в засушливых областях земного шара и составляющих около 60 % всей поверхности суши. Мировое потребление воды в начале XXI века достигло 120–150 × 109 м3/год. Растущий мировой дефицит пресной воды может быть скомпенсирован опреснением соленых (солесодержание более 10 г/л) и солоноватых (2–10 г/л) океанических, морских и подземных вод, запасы которых составляют 98 % всей воды на земном шаре. В данной статье рассмотрены основы современных методов и технологий опреснения морской воды.
Пресная вода является ценной составной частью морской воды. Нехватка пресной воды все больше ощущается в индустриально развитых странах, таких как США и Япония, где потребность в пресной воде для бытовых нужд, сельского хозяйства и промышленности превышает имеющиеся запасы. В таких странах как Израиль или Кувейт, где уровень осадков очень низок, запасы пресной воды не соответствуют потребностям в ней, которые возрастают в связи с модернизацией хозяйства и приростом населения. В дальнейшем человечество окажется перед необходимостью рассматривать океаны как альтернативный источник воды.
Россия по ресурсам поверхностных пресных вод занимает первое место в мире [1]. Однако, до 80 % этих ресурсов приходится на районы Сибири, Севера и Дальнего Востока. Всего около 20 % пресноводных источников расположено в центральных и южных областях с самой высокой плотностью населения и высокоразвитыми промышленностью и сельским хозяйством. Некоторые районы Средней Азии (Туркмения, Казахстан), Кавказа, Донбасса, юго-восточной части РФ, обладая крупнейшими минерально-сырьевыми ресурсами, не имеют источников пресной воды. Вместе с тем, ряд районов нашей страны располагает большими запасами подземных вод с общей минерализацией от 1 до 35 г/л, не используемых для нужд водоснабжения из-за высокого содержания растворенных в воде солей. Эти воды могут стать источниками водоснабжения только при условии их дальнейшего опреснения.

Важным параметром морской воды при опреснении является соленость, под которой подразумевается масса (в граммах) сухих солей (преимущественно NaCl) в 1 кг морской воды. Средняя соленость вод мирового океана постоянна и составляет 35 г/кг морской воды [2].Наряду с NaCl в морской воде содержатся K+, Mg2+, Ca2+, Sr2+, Br–, F–, H3BO3 (табл. 1), которые можно получать из морской воды в промышленных масштабах. Среди других веществ, содержащихся в морской воде в концентрациях от 1 млн долей (миллионная доля) до 0,01 млн долей, встречаются литий Li, рубидий Rb, фосфор P, йод J, железо Fe, цинк Zn и молибден Mo [3]. Кроме этих элементов в морской воде обнаружено около тридцати других элементов в более низких концентрациях [4].
Высокая концентрация солей делает морскую воду непригодной для питьевых и хозяйственных целей. Поэтому ее необходимо опреснять, т.е. проводить обработку с целью снижения концентрации растворенных солей до 1 г/л. Опреснение воды может осуществляться химическими (химическое осаждение, ионный обмен), физическими (дистилляция, обратный осмос или гиперфильтрация, электродиализ, вымораживание) и биологическими методами с использованием способности некоторых фотосинтезирующих водорослей избирательно поглощать NaCl из морской воды [5].
За последние годы были также предложены новые альтернативные методы опреснения морской воды за счет воздействия ультразвуком, акустическими, ударными волнами, электромагнитными полями и др. [6].Многообразие существующих методов получения пресной воды объясняется тем, что ни один из них не может считаться универсальным, приемлемым для данных конкретных условий. Характеристики методов опреснения, получивших наибольшее практическое применение, приводятся ниже.
Химическое осаждение
При химическом способе опреснения в морскую воду вводят специальные осаждающие реагенты, которые при взаимодействии с растворенными в ней ионами солей (хлориды, сульфаты), образуют нерастворимые, выпадающие в осадок соединения. Вследствие того, что морская вода содержит большое количество растворенных веществ, расход реагентов весьма значителен и составляет примерно 3–5 % количества опресненной воды. К веществам, способным образовывать нерастворимые соединения с ионами натрия (Na+) и хлора (Cl–),относятся соли серебра (Ag+) и бария (Ba2+), которые при обработке соленой воды образуют выпадающие в осадок хлористое серебро (AgCl) и сернокислый барий (BaSO4). Эти реагенты дорогостоящие, реакция осаждения с солями бария протекает медленно, соли бария токсичны. Поэтому химическое осаждение при опреснении воды используется очень редко.
Дистилляция
Дистилляция воды (перегонка) основана на различии в составе воды и образующегося из нее пара [7]. Процесс осуществляется в специальных дистилляционных установках-опреснителях путем частичного испарения воды и последующей конденсации пара. В процессе дистилляции более летучий компонент (низкокипящий) переходит в паровую фазу в большем количестве, чем менее летучий (высококипящий). Поэтому при конденсации образовавшихся паров в дистиллят переходят низкокипящие, а в кубовый остаток — высококипящие компоненты. Если из исходной смеси отгоняется не одна фракция, а несколько, дистилляция называется фракционной (дробной). В зависимости от условий процесса различают простую и молекулярную дистилляцию [8].
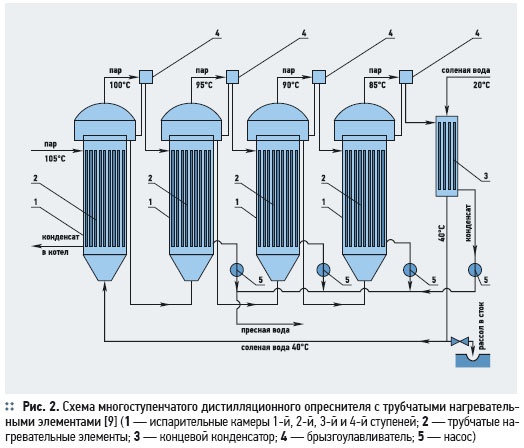
Дистилляционная опреснительная установка (рис. 1) состоит из испарителя 1, снабженного теплообменным устройством для подвода к воде необходимого количества теплоты; нагревательного элемента 2 для частичной конденсации пара, выходящего из испарителя (при фракционной дистилляции); конденсатора 3 для конденсации отбираемого пара; насоса 4; сборников дистиллята 5 и кубового остатка 6. Современные дистилляционные опреснители подразделяются на одноступенчатые, многоступенчатые с трубчатыми нагревательными элементами, или испарителями, многоступенчатые с мгновенным вскипанием и парокомпрессионные [9].
Например, многоступенчатый испаритель (рис. 2) состоит из ряда последовательно работающих испарительных камер с трубчатыми нагревательными элементами. Нагреваемая соленая вода движется внутри трубок нагревательного элемента, греющий пар конденсируется на внешней поверхности. При этом нагрев и испарение воды в первой ступени осуществляются паром рабочего котла, работающего на дистилляте; греющим паром следующей ступеней служит вторичный пар предыдущей испарительной камеры. Данная установка способна вырабатывать около 0,9 т пресной воды на 1 т первичного пара.
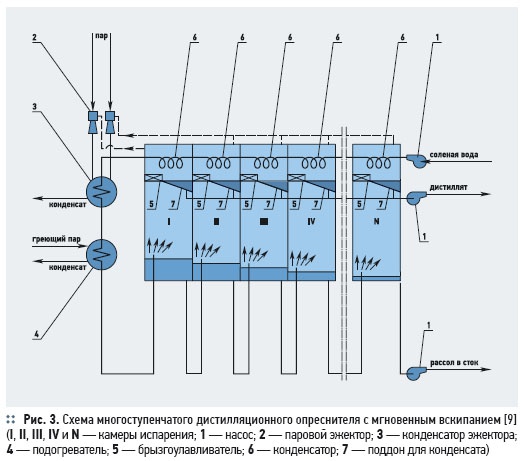
Расход тепла на получение 1 кг пресной воды в одноступенчатом дистилляционном опреснителе составляет около 2400 кДж.В опреснителях с мгновенным вскипанием (рис. 3) соленая вода проходит последовательно через конденсаторы, встроенные в испарительные камеры, нагреваясь за счет тепла конденсации, затем поступает в главный подогреватель и нагревается выше температуры кипения воды в первой испарительной камере, где происходит процесс кипения. Затем пар конденсируется на поверхности трубок конденсатора, а конденсат стекает в конденсатор и насосом откачивается потребителю. Неиспарившаяся вода перетекает через гидрозатвор в следующую камеру с более низким давлением, где она снова вскипает, и т.д. Рекуперация тепла фазового перехода в многоступенчатом опреснителе позволяет снизить расход тепла по сравнению с одноступенчатым дистилляционным опреснителем на 1 кг пресной воды до 250–300 кДж. Основным преимуществом многоступенчатых дистилляционных опреснительных установок является то, что на единицу первичного пара можно получить значительно большее количество обессоленной воды. Так при одноступенчатом испарении на 1 т первичного пара получают около 0,9 т опресненной воды, а на установках, имеющих 50–60 ступеней — 15–20 т опресненной воды. Удельный расход электроэнергии в дистилляционных установках составляет 3,5–4,5 кВт⋅ч/м3 дистиллята.
Осуществление любого варианта процесса дистилляции связано с большими затратами тепловой энергии, составляющими 40 % от стоимости получаемой воды (если проводить дистилляцию в вакууме, температура кипения воды понижается до 60 °C, и дистилляция требует меньших тепловых затрат). В качестве источников тепловой энергии используются атомные и тепловые электростанции. Сочетание дистилляционной установки с тепловой электростанцией на минеральном или ядерном топливе (т.н. «многоцелевая энергетическая установка») позволяет обеспечить промышленный район всеми видами энергетических услуг по минимальной себестоимости при наиболее рациональном использовании топлива. В пустынных южных районах и на безводных островах применяются солнечные опреснители, которые производят в летние месяцы около 4 л воды в сутки с 1 м2 поверхности, воспринимающей солнечную радиацию.
Эффективность работы дистилляционных испарителей ограничена образованием накипи в системе циркуляции горячего рассола. По мере выпаривания морской воды из дистилляционного опреснителя раствор соли становится более концентрированным и в конечном итоге осаждается на стенках аппарата в виде накипи из солей жесткости, состоящих, главным образом, из хлоридов и карбонатов кальция (CaCO3, CaCl2) и магния (MgCO3, MgCl2) [10], что ухудшает теплопроводность стенок теплообменника, приводит к разрушению труб и теплообменного оборудования. Это требует применения специальных антинакипных добавок, что существенно увеличивает энергозатраты на проведение дистилляции до 10 кВт⋅ч/м3 обессоленной воды. Поэтому в последние годы предложены другие способы опреснения морской воды, которые не связаны с необходимостью ее испарения и конденсации.
Ионный обмен
Метод основан на свойстве твердых полимерных смол разной степени сшивки, ковалентно связанных с ионогенными группами (иониты), обратимо обмениваться ионами растворенных в воде солей (противоионы) [11].В зависимости от заряда иониты подразделяются на положительно заряженные катиониты (H+) и отрицательно заряженные аниониты (OH–). В катионитах — веществах, аналогичным кислотам — анионы представлены в виде нерастворимых в воде полимеров, а катионы (Na+) подвижны и обмениваются с катионами растворов. В противоположность катионитам, аниониты по химической структуре являются основаниями, нерастворимую структуру которых образуют катионы. Их анионы (обычно гидроксильная группа ОН–) способны обмениваться с анионами растворов.
Процесс ионообменного опреснения воды заключается в последовательном прохождении воды через неподвижный слой ионита в периодическом процессе или противоточным движением воды и ионита в непрерывном процессе (рис. 4). В этом процессе катионы и анионы солей обрабатываемой воды последовательно связываются с ионитами, в результате происходит ее обессоливание. Соотношение ионита, анионита и катионита обычно составляет от 1:1 до 1,5:1,0 по массе [12].
Кинетика ионного обмена включает три последовательные стадии: перемещение сорбируемого иона к поверхности глобулы ионита (1), ионный обмен (2), перемещение вытесняемого иона внутри глобулы ионита и от его поверхности в растворе (3) [13].
На скорость ионного обмена влияют следующие факторы: доступность фиксированных ионов внутри каркаса ионита, размер гранул ионита, температура, концентрация раствора [14]. Общая скорость процесса ионного обмена определяется совокупностью процессов, происходящих в растворе (диффузия противоионов к грануле и от гранулы ионита) и в ионите (диффузия противоионов от поверхности к центру гранулы ионита и в обратном направлении; обмен противоионов ионита на противоионы из раствора). В условиях, приближенных к реальным условиям очистки воды, лимитирующим фактором, определяющим скорость ионного обмена, является диффузия ионов внутри гранулы ионита.
Обменная способность ионообменных смол постепенно снижается, и, в конечном итоге, исчерпывается. В этом случае требуется регенерация раствором кислоты (катионит) или щелочи (анионит), что восстанавливает исходные химические свойства смол. Катионит регенерируется 5 %м раствором H2SO4, которую пропускают последовательно через катионит до появления кислой реакции. Удельный расход серной кислоты 55–60 г/гэкв сорбированных катионов. Анионит регенерируется 5 %м раствором CaCO3 или NaOH с расходом 70–75 г на 1 гэкв задержанных анионов.
Ионный обмен применяется для получения обессоленной и умягченной воды в тепловой и атомной энергетике и в промышленности; в цветной металлургии при комплексной гидрометаллургической переработке руд, в пищевой промышленности, в медицинской промышленности при получении антибиотиков и других лекарственных средств, а также для очистки сточных вод в целях организации оборотного водоснабжения. В настоящее время также разрабатываются ионообменные методы комплексного извлечения из океанской воды ценных минералов [15].
Промышленные аппараты для реализации ионного обмена подразделяются на три группы: установки типа смесителей-отстойников, установки с неподвижным и подвижным слоями ионита. Аппараты первого типа чаще всего используют в гидрометаллургии. В аппаратах с неподвижным слоем ионита исходные и обессоленные растворы подаются в одном направлении (поточные схемы) или в противоположных (противоточные схемы). Такие аппараты используются для ионообменной очистки растворов, при умягчении и обессоливании морской воды. В непрерывно действующих противоточных аппаратах подвижный ионит перемещается сверху вниз под действием силы тяжести. Конструктивно противоточные аппараты подразделяются на три группы: со взвешенным или кипящим слоем ионита, с непрерывным движущимся слоем ионита и с движущимся раствором через ионит. В зависимости от заданной степени обессоливания воды проектируют одно, двух и трехступенчатые ионообменные установки. Остаточное солесодержание при одноступенчатом ионообменном опреснении составляет 20 мг/л. Для получения воды с солесодержанием до 0,5 мг/л применяют установки с двухступенчатой схемой Н+ и ОН–ионирования.
Ионообменный способ опреснения воды имеет ряд достоинств: простота оборудования, малый расход исходной воды на собственные нужды (15–20 % производительности установки), малый расход электроэнергии, малый объем сбросных вод.
Недостаток ионообменного метода — сравнительно высокий расход реагентов, технологическая сложность процесса, который лимитируется исходным уровнем солесодержания обрабатываемой воды, определяющегося экономическими затратами. Рентабельность ионного обмена при опреснении воды обычно ограничивается исходным содержанием растворенных солей 1,5–2,5 г/л. Однако, при необходимости, когда себестоимость воды не играет существенной роли, этим методом можно опреснять воду с достаточно высоким солесодержанием. Продолжение в следующем номере.
1. Алекин О.А. Химия океана. — Л., 1966.
2. Хорн Р. Морская химия. — M., 1972.
3. Монин А.С. Океанология. Химия океана. — М., 1979.
4. Виноградов А.П. Геохимия океана. — М., 1989.
5. Kimm Y, Logan B.E., Electrodialysis Cells for Partial or Complete Seawater Desalination // Environmental Science and Technology, 2011, V. 12.
6. Абдулкеримов С.А., Богданов В.П., Годин С.М. Опытные исследования энергоинформационных воздействий излучений генератора продольных электромагнитных волн с водой // Электродинамика и техника СВЧ и КВЧ, №3(8)/2000.
7. Коган В.Г. Теоретические основы типовых процессов химической технологии. — Л., 1977.
8. Сийрде Э.К. Дистилляция. — М., 1991.
9. Гельперин Н.И. Основные процессы и аппараты химической технологии. — М., 1981.
10. Мосин О.В. Магнитные системы обработки воды. Основные перспективы и направления // Сантехника, №1/2011.
11. Кокотов Ю.А. Иониты и ионный обмен. — Л., 1980.
12. Горшков В.И., Сафонов М.С., Воскресенский Н.М. Ионный обмен в противоточных колоннах. — М., 1981.
13. Сенявин М.М. Ионный обмен. — М., 1981.
14. Батлер Дж.Н. Ионные равновесия. — Л., 1973.
15. Слесаренко В.Н. Современные методы опреснения морских и соленых вод. — М., 1973.
16. Дытнерский Ю.И. Обратный осмос и ультрафильтрация. — М.: Химия, 1978.
17. Свитцов А.А. Введение в мембранные технологии. — М.: «ДеЛи принт», 2006.
18. Орлов Н.С. Промышленное применение мембранных процессов. — М.: РХТУ им. Д.И. Менделеева, 2007.
19. Каграманов Ш.Г. Диффузионные мембранные процессы. Ч. 2. — М.: РХТУ им. Д.И. Менделеева, 2007.
20. Кульский Л.А. Опреснение воды. — К., 1980.
21. Орехов И.И., Обрезков Д.И. Вымораживание. Холод в процессах химической технологии. — Л., 1980.
22. Пап Л. Концентрирование вымораживанием. — М., 1982.
23. Алиев А.М., Юсифов Р.Ю., Кулиев А.Р., Юсифов Ю.Г. Применение методики гидратообразования для оценки обессоливания воды // Прикладная химия, №51(4)/2008.
24. Мосин О.В. Исследование методов биотехнологического получения аминокислот, белков и нуклеозидов, меченных стабильными изотопами 2Н и 13С с высокими уровнями изотопного обогащения. Автореф. дисс. к.х.н. — М.: МГАТХТ им. М.В. Ломоносова, 1996.
Установки опреснения морской воды
Опубликовано в журнале
СОК №12 | 2011
Глобальной проблемой человечества в новом тысячелетии становится проблема получения пригодной для питья пресной воды. Например, ряд районов нашей страны располагает большими запасами подземных вод с общей минерализацией от 1 до 35 г/л, не используемых для нужд водоснабжения из-за высокого содержания растворенных в воде солей. Эти воды могут стать источниками водоснабжения только при условии их дальнейшего опреснения.
























