
Во-первых, глубина окисления Fe3+/Fe2+ является расчётной величиной, показывающей предельное теоретическое соотношение трёхи двухвалентного железа при конкретных условиях. Назовём её Fe3+/Fe2+пред. По расчётным данным (на основе имевшихся у автора результатов анализов воды), отношение Fe3+/Fe2+пред после фильтров обезжелезивания должно находиться в диапазоне от 0,4 до 3000. Однако натурные наблюдения показывают, что после стадии фильтрации Fe3+/Fe2+ редко составляет более 10, а чаще находится в пределах 1,5–2,0. Во-вторых, следует разъяснить роль кислорода в протекании процесса, учитывая, что с ростом его концентрации глубина окисления снижается.
По мнению автора, оба замечания связаны со временем протекания процесса окисления в сооружениях водоподготовки, о чём дальше и пойдёт речь.
Скорость химической реакции (измеряемая обычно в [моль·л/с]) определяется законом действующих масс (законом Гульдберга — Вааге), согласно которому скорость прямо пропорциональна концентрациям действующих веществ, возведённым в стехиометрические коэффициенты. Учитывая, что в системе протекают как прямая, так и обратная реакции, то скорости прямой v1 и обратной v2 реакций для химического уравнения
Аа + Bb = Cc + Dd (1)
будут равны
v1 = k1AaBb и v2 = k2CcDd, (2)
где k1 и k2 — константы скоростей прямой и обратной реакций.
При равенстве скоростей v1 и v2 наступает динамическое равновесие, и тогда
k1AaBb = k2CcDd. (3)
Выражение (3) можно представить в виде
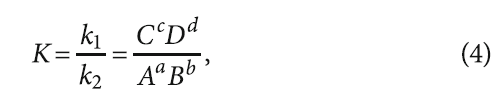
где K — константа химического равновесия данной реакции.
Из уравнения (2) нетрудно заметить, что по ходу реакции количество исходных веществ уменьшается, следовательно, снижается и скорость прямой реакции, а обратной, наоборот, возрастает.
Для реакции окисления двухвалентного железа до трёхвалентного
4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (5)
константа химического равновесия составляет K = 1,05×1031, что свидетельствует о смещении химического равновесия вправо настолько, что обратной реакцией можно пренебречь, то есть обратного процесса восстановления двухвалентного железа из трёхвалентного практически не происходит.
Скорость прямой реакции при этом будет выражена как
v1 = k1[Fe2+]4[O2][H+]4. (6)
Следует заметить, что в реакции (5) один моль кислорода взаимодействует с четырьмя молями двухвалентного железа, то есть на окисление 1 мг двухвалентного железа расходуется 0,29 мг кислорода. Поскольку, по данным наблюдений, содержание кислорода даже в неаэрированной исходной подземной воде составляло не менее 1,2 мг/л, то можно считать, что кислорода практически всегда достаточно для полного прохождения реакции, особенно после аэрирования воды. Хотя, если говорить строго, малое содержание кислорода соответствует малой скорости протекания реакции, что и следует из уравнения (6). Также отмечено, что рН воды при протекании реакции существенно не меняется. Следовательно, примем, что скорость прямой реакции v1 зависит исключительно от содержания двухвалентного железа Fe2+.
Реакцию (5), по мнению автора, можно рассматривать как гомогенную (полагая, что реагируют растворённые вещества) или гетерогенную (полагая, что реагируют растворённые вещества в ионной форме с газом). Порядок химической реакции должен определяться опытным путём.

Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью. Химически чистое железо получают электролизом его солей
Продифференцируем выражение (6) по времени:
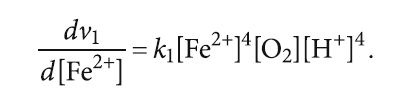
Решением данного уравнения будет
k1[O2][H+]4[Fe2+]5. (7)
В свою очередь, скорость окисления v1 является частным от деления d[Fe2+]/dτ, где τ — время. Тогда
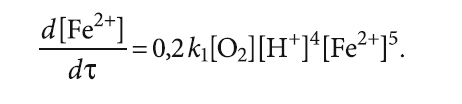
Отсюда
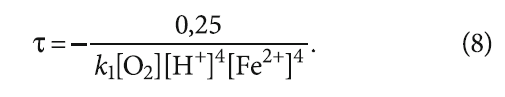
Выражение (8) показывает, что окисление двухвалентного железа наступает быстрее при более низких значениях рН и при росте содержания кислорода, хотя при этом глубина окисления снижается, как было показано ранее.
Следует заметить, что содержание кислорода [O2] при принудительной аэрации с помощью эжектора или компрессора в точке подачи воздуха может быть выше, чем показывают анализы очищенной (обезжелезенной) воды, поскольку, согласно уравнению Генри — Дальтона, растворимость газов (в нашем случае кислорода) прямо пропорциональна давлению подаваемого газа.
Знак «минус» в формуле (8) смущать не должен, так как содержание двухвалентного железа [Fe]i изменяется от [Fe]исх до [Fe]пред, определяемого соотношением Fe3+/Fe2+.
Подставив [Fe]исх и [Fe]i в (7), получим следующее выражение
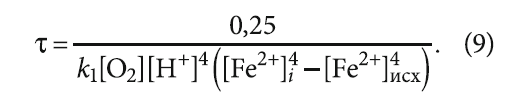
В выражении (9) известны (определяются анализами воды) значения всех параметров, кроме константы скорости прямой реакции k1.
В рассмотренном в [1] примере заданы следующие показатели качества воды (после устройств аэрации): [O2] = 2,5 мг/л, рН = 7,1, исходное содержание [Fe2+]исх примем равным содержанию общего железа на входе в сооружения — 1,0 мг/л. Концентрации тех же веществ, выраженные в [моль/л], будут следующими: [O2] = 7,81×10–5 моль/л, [H+] = 10–7,1 моль/л, [Fe2+]исх = 3,58×10–5 моль/л. Тогда
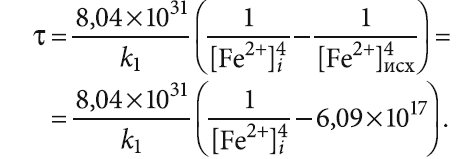
Конечное значение [Fe2+]i можно принять равным 0,3 мг/л (1,08×10–5 моль/л), как предельно допустимое содержание железа согласно СанПиН 2.1.3684–21, предполагая при этом, что трёхвалентное железо будет почти полностью гидролизировано и выделится в виде малорастворимого осадка. И тогда
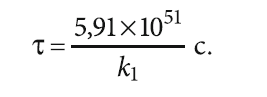
В данном выражении неизвестным является значение константы скорости химической (в данном случае прямой) реакции k1. Изменение концентрации двухвалентного железа во времени (без учёта значения k1) показано на рис. 1. Из рис. 1 видно, что сначала концентрация двухвалентного железа быстро снижается, а затем, примерно с 0,3–0,4 мг/л, это снижение резко замедляется. Для достижения [Fe2+] = 0,1 мг/л требуется уже весьма значительное время. Видимо, это одна из причин того, что уменьшить содержание одного из исходных веществ реакции ниже определённого предела бывает крайне затруднительно.
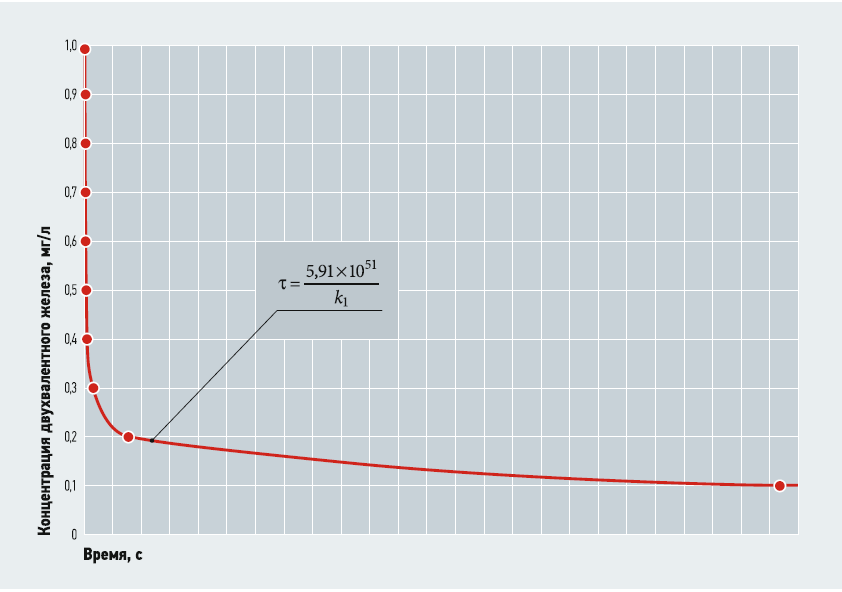
Рис. 1. Изменение концентрации двухвалентного железа во времени (без учёта значения k1)
Оценить непосредственно время окисления до некого [Fe2+]i не представляется возможным вследствие отсутствия достоверных значений k1.
Как известно, константа скорости реакции не зависит от концентрации веществ, а зависит от температуры. Эта зависимость выражается уравнением Аррениуса, которое имеет следующий вид:

где А — предэкспоненциальный множитель, который характеризует частоту столкновений реагирующих молекул (ионов); Ea — энергия активации — минимальная энергия частиц (молекул, атомов, ионов), достаточная для того, чтобы они вступили в реакцию, преодолев потенциальный энергетический барьер; R — универсальная газовая постоянная; Т — абсолютная температура.
Собственно, уравнение Аррениуса для наших изысканий ничего не даёт, так как величины А и Еа определяются опытным путём, что невозможно, имея только данные наблюдений за работой сооружений водоподготовки. С другой стороны, уравнение Аррениуса позволяет понять некоторые закономерности процесса на качественном уровне.

При насыщении обрабатываемой воды кислородом воздуха увеличиваются глубина окисления двухвалентного железа (за счёт роста Eh) и скорость процесса. Если процесс происходит в свободном объёме вне какой-либо фильтрующей загрузки, то скорость прямой реакции определяется константой k1, зависящей от температуры. Однако окисление двухвалентного железа до трёхвалентного в большей степени происходит не в устройствах аэрации, а в слое фильтрующей загрузки, которая может обладать каталитическими свойствами, либо, что ещё важнее, приобретает каталитические свойства за счёт образования плёнки из ранее выпавшего осадка, то есть процесс становится «автокаталитическим».

Одним из свойств катализатора является способность изменять механизм реакции на энергетически более выгодный, то есть снижать энергию активации Еа. При этом, в соответствии с уравнением Аррениуса, повышается константа скорости прямой реакции k1. С другой стороны, растёт и константа обратной реакции, но для случая обезжелезивания воды это не имеет существенного значения, так как реакция (4) сильно смещена влево, а трёхвалентное железо, по-видимому, легко подвергается гидролизу уже при рН более 4,7 и щёлочности 1 ммоль/л и более (см. [2]) с образованием малорастворимого осадка. Поскольку состояние фильтрующей загрузки при обезжелезивании постоянно меняется, то следует предположить и постоянное изменение значения k1, что объясняет, по-видимому, нестабильную эффективность обезжелезивания во время фильтроцикла: сначала рост эффективности, затем стабилизация качества воды, а далее падение эффективности вплоть до «проскока» повышенных концентраций железа. Изменение значения k1 в ходе процесса фильтрации и, соответственно, скорости окисления двухвалентного железа предполагает куда более сложный характер изменения концентрации двухвалентного (не окислённого) железа по времени, чем показывает рис. 1.
Здесь не рассматривается другая важнейшая составляющая процесса — работа самой загрузки в процессе фильтрации по задержанию и накоплению взвеси. Следует отметить, что изучение процесса фильтрования в течение многих десятилетий не дало существенных результатов для описания процесса с точки зрения практических расчётов (в частности, диссертация автора была посвящена теме фильтрации воды через зернистые загрузки).
Таким образом, изучение и расчёт значений k1 для различных технологических режимов работы сооружений обезжелезивания может быть отдельной интересной и полезной задачей для специалистов по химии воды и водоподготовке.

























