Предыстория вопроса: в журнале С.О.К. (№7/2017) был опубликован ответ инженера-наладчика Д. Ф. Янченко.
Прежде всего хотелось бы оговориться, что с моей стороны в данном случае была скорее не критика, а обсуждение полученных Д. Ф. Янченко результатов, которые следует признать весьма полезными как с точки зрения накопления знаний о процессе обезжелезивания, так и их осмысления с точки зрения химической теории. Проблема видится в общем недостаточном понимании того, каким образом происходит удаление железа из воды. Причём такого понимания нет не только на уровне рядовых специалистов (технологов и наладчиков), но и признанных авторитетов в области водоподготовки. Множество утверждений просто принимается на веру без малейшей возможности проверить их достоверность на основании действительно проведённых кемлибо опытов. Вывод Д. Ф. Янченко в статье [4], что «обезжелезивание подземных вод с рН < 6,8 не объясняется ни теоретическими, ни практическими наработками по водам с рН ≥ 6,8» следует отнести именно к недостаточности теоретического обоснования процессов водоочистки вообще и обезжелезивания в частности. Несомненно, что в основе процесса обезжелезивания при любых значениях рН лежат одни и те же химические и физико-химические закономерности, поэтому разделение их на «до» и «после» рН = 6,8 выглядит неправомерным.
В табл. 1 представлены результаты анализов исходной подземной и очищенной воды на нескольких станциях обезжелезивания Московской области. Индексы 1.1–1.6 относятся к показателям качества исходной воды, а 2.1–2.6 — к показателям качества очищенной воды, соответственно. Помимо обычных показателей — содержания общего железа Feобщ, двухвалентного железа Fe2+, рН, щёлочности, — определялись: общая жёсткость, содержание кальция Ca2+, растворённого кислорода O2 (в мг/л и процентах от максимального насыщения при данной температуре и атмосферном давлении), окислительно-восстановительный потенциал Eh. Во всех случаях окисляемость воды не превышала нормативных значений СанПиН 2.1.4.1074–01.
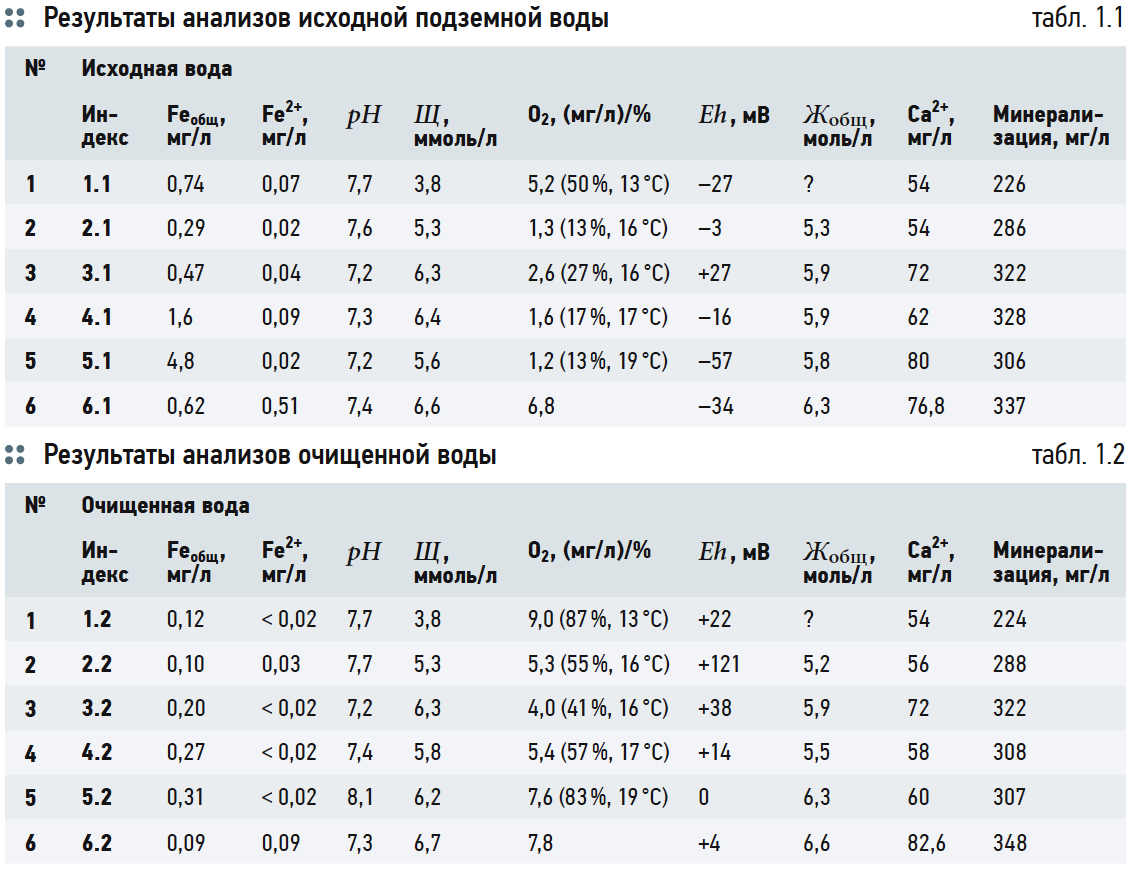
Обезжелезивание воды проводилось методом принудительной аэрации с использованием компрессора и аэрационных колонн с последующей обработкой на напорных зернистых фильтрах, загруженных фильтрующим материалом «Сорбент АС» крупностью 0,7–1,5 мм. Данные табл. 1 показывают, что эффект умягчения наблюдался только в опыте №4 (с 5,9 до 5,5 ммоль/л). В других случаях умягчения или не наблюдалось, или даже отмечалось увеличение жёсткости при том, что рН всегда заведомо был выше 6,8. Также наблюдалось как снижение, так и рост минерализации и содержания кальция; в опытах 1–3 значительных изменений не отмечено.
Представленные результаты показывают, с одной стороны, неоднозначность выводов относительно процессов умягчения и деминерализации воды при её обезжелезивании в зависимости от рН, с другой — несомненность того факта, что процесс обезжелезивания сопровождается изменением ряда других показателей качества. Стоит при этом оговориться: не вполне понятно, вызваны ли эти изменения непосредственно удалением ионов железа из воды, либо сказывается влияние аэрации, о чём подробно говорилось в статьях [10, 11]. Столь сложный процесс, разумеется, требует полноценного теоретического обоснования, которое к настоящему времени нельзя признать удовлетворительным, а некоторые устоявшиеся понятия явно требуют определённого разъяснения и уточнения.
Например, относительно форм существования железа в подземных водах в [5] сказано следующее: «Преобладающей формой существования железа в подземных водах является бикарбонат железа (II), который устойчив только при наличии значительных количеств углекислоты и отсутствии растворённого кислорода. Наряду с этим железо встречается в виде сульфида, карбоната и сульфата железа (II)…».
Упоминание о наличии в воде бикарбонатов (гидрокарбонатов), карбонатов, сульфатов есть в хорошо известных изданиях [6–8] и других работах. Однако, если взять реальные протоколы анализа качества воды, то там можно встретить не только щёлочность (карбонаты и гидрокарбонаты), сульфиды и сульфаты, но другие анионы — нитриты, хлориды, фториды, фосфаты. С этой точки зрения можно сказать, что двухвалентное железо содержится в подземных водах в виде сульфатов, хлоридов, нитратов и т.п.
Разумеется, гидрокарбонаты в природных водах являются преобладающими анионами, но некорректной выглядит сама постановка вопроса: анионы и катионы диссоциированных солей находятся в низкоконцентрированном растворе независимо друг от друга (влияние ионной силы раствора в данном случае не рассматривается). Поэтому более правильным является определение, что растворённое двухвалентное железо в подземных водах находится в виде ионов Fe2+, как указано в издании [9].
Основным методом обезжелезивания является перевод железа из растворимой в нерастворимую форму с последующим отделением из воды полученной твёрдой фазы. При этом протекают реакции окисления и гидролиза. Приведём несколько вариантов записи данных реакций из разных изданий и справочников:
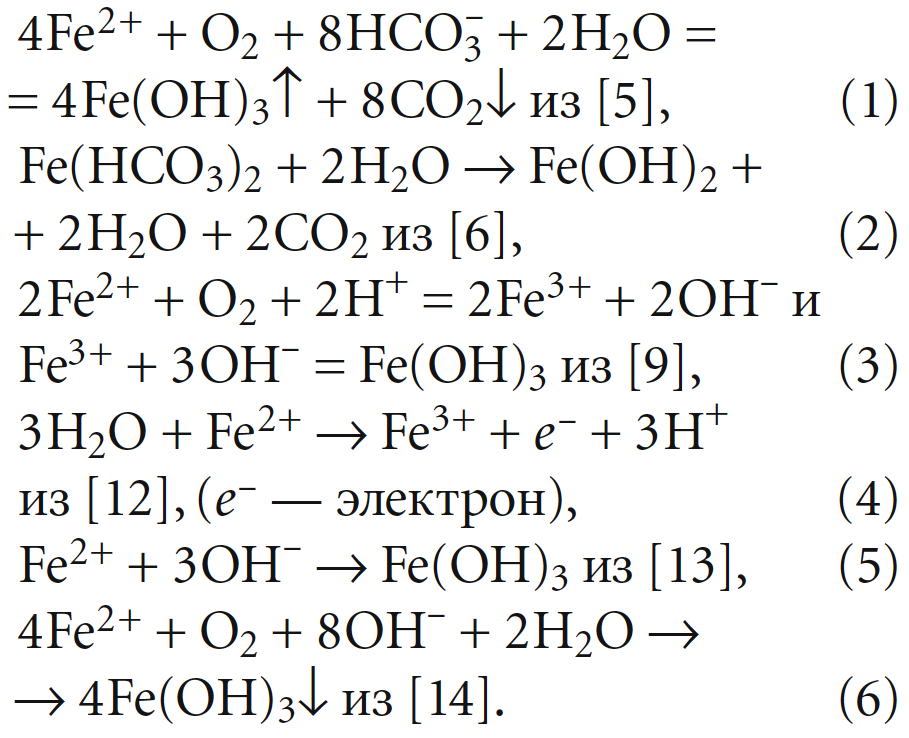
При общей схожести уравнений (1)–(6) между ними имеются и существенные различия, что довольно странно, если рассматривается один и тот же хорошо известный процесс. Не вполне ясно также, идёт ли речь только об окислении или о гидролизе. Действительно, Fe(OH)3 является почти нерастворимым соединением, но то же можно сказать и о Fe(OH)2.
В справочной литературе приведены значения произведения растворимости для Fe(OH)2 и Fe(OH)3, соответственно: 8,0 × 10–16 и 4,0 × 10–38 при температуре 25 °C. Растворимость S для электролита AmBn (А — катион, В — анион) связана с произведением растворимости ПР следующим выражением:

Согласно формуле (7) растворимость SFe(OH)2 составит 5,85 × 10–6 моль/л, SFe(OH)3 — 1,96 × 10–10 моль/л или, с учётом молярной массы [Fe(OH)2 = 89,8 г/моль], [Fe(OH)3 = 106,8 г/моль], 0,53 и 0,000021 мг/л, соответственно. Отсюда на долю ионов Fe2+ и Fe3+ пришлось бы всего 0,33 и 1,09 × 10–5 мг/л, соответственно.
То есть практически все гидроксиды железа в подземных водах находились бы в нерастворённом состоянии, а проблема повышенного содержания железа была бы крайне редка. Однако в действительности всё обстоит совершенно иначе.
Хотя при проведении лабораторных анализов учитываются все формы железа (растворённое, коллоидное, в виде взвешенных частиц), но также несомненно, что основным источником для всех остальных форм являются ионы Fe2+ (комплексные соединения железа, в том числе с органическими соединениями, здесь не рассматриваются). Напрашивается очевидный вывод: ионы Fe3+ в одних и тех же условиях гидролизуются значительно лучше, чем Fe2+.
В общем виде реакция гидролиза соли, образованной слабым основанием и сильной кислотой, записывается так:
МА + НОН ↔ НА + МОН, (8)
где М — катион; А — анион.
Или в ионной форме:
М+ + НОН ↔ Н+ + МОН. (9)
Константа равновесия данной реакции

Так как концентрация молекул воды НОН в растворе постоянна, то произведение двух постоянных К·[HOH] можно заменить константой Кг, которую называют константой гидролиза.
Путём несложных преобразований из уравнения (10) получается уравнение для константы гидролиза:
Kг = Kw/Kд, (11)
где Kw — ионное произведение воды, Kw = 10–14; Кд — константа диссоциации слабого основания.
Хотя часто указывают, что в природной подземной воде железо содержится в виде гидрокарбонатов (что не совсем корректно), то есть в соединении со слабой кислотой, но, поскольку в любом случае рассматривается ионная форма железа, использование уравнения (11) представляется правомерным.
Чем выше значение константы гидролиза, тем полнее он происходит. В силу того, что предыдущая ступень диссоциации всегда выше последующей, гидролиз по первой ступени происходит всегда более полно, чем по следующим.
Так как катионы Fe2+ и Fe3+ многовалентны, то их гидролиз происходит ступенчато (Кд — константы диссоциации):
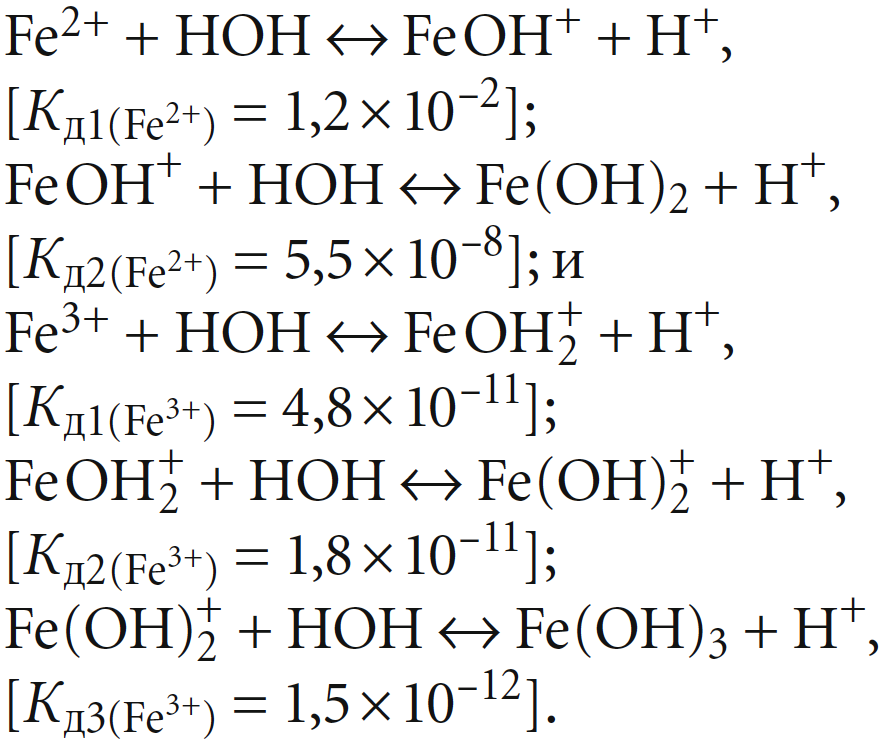
Показанные значения констант диссоциации ионов Fe2+ и Fe3+ позволяют рассчитать соответствующие значения констант гидролиза, которые составят:
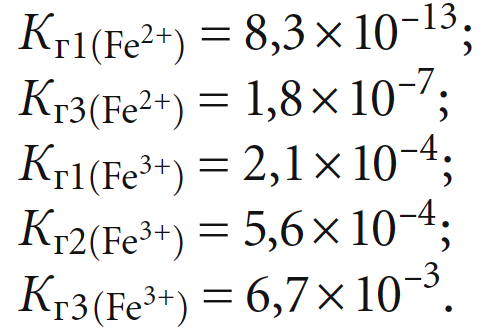
Таким образом, степень протекания гидролиза при одинаковых внешних условиях для трёхвалентного железа всегда минимум на три порядка выше, чем для двухвалентного, почему и наблюдается интенсивное образование осадка Fe(OH)3 в отличие от Fe(OH)2.
Опытным путём установлено, что осадок, выделенный из промывных вод станций обезжелезивания, состоит в значительной мере из соединений трёхвалентного железа: например, в исследовании [15] показано, что 42–44 % осадка приходится на Fe2O3, соединений двухвалентного железа не отмечено.
Предполагается, что с течением времени в фильтрующей загрузке из свежевыпавшего осадка Fe(ОН)3 происходит образование гидрата окиси железа Fe2O3·nН2О, хотя закономерности и скорость этого процесса пока малопонятны.
Во всяком случае отметим, что необходимость окисления Fe2+ до Fe3+ достоверно установлена и подтверждается как теоретически, так и по опыту работы станций обезжелезивания.
При реакции гидролиза происходит выделение ионов Н+, что влияет на углекислотное равновесие в воде в соответствие с уравнением:
H2O + CO2 ↔ Н+ + HCO3– ↔ 2Н+ + CO32–. (12)
Вследствие накопления ионов Н+ происходит перераспределение углекислотного равновесия, снижение рН и щёлочности. Надо отметить, что в то время как при гидролизе двухвалентного железа значение рН снижается, аэрация воды (которая применяется при обезжелезивании в подавляющем большинстве случаев) при исходном рН < 8, наоборот, повышает рН (см. [10, 11]).
Определить расчётным путём конечное значение рН не представляется возможным, хотя чаще при обезжелезивании происходит его повышение.
Следовательно, очевидно, что для эффективного обезжелезивания необходимо по возможности более полное и быстрое окисление Fe2+ до Fe3+.
При этом реакция окисления двухвалентного железа до трёхвалентного обычно записывается так:
4Fe(OH)2 + O2 + H2O → 4Fe(OH)3.(13)
В данной реакции и окисление, и гидролиз происходят в одну стадию, что не исключает возможности и двухстадийного протекания процесса: сначала окисление согласно реакции Fe2+ → Fe3+ + e– (е– — электрон), а затем ступенчатый гидролиз до Fe(OH)3. Возможность протекания процесса в две стадии основывается на рассмотрении диаграммы Пурбе, показывающей формы существования химических элементов при различных значениях pH и окислительно-восстановительного потенциала Eh.
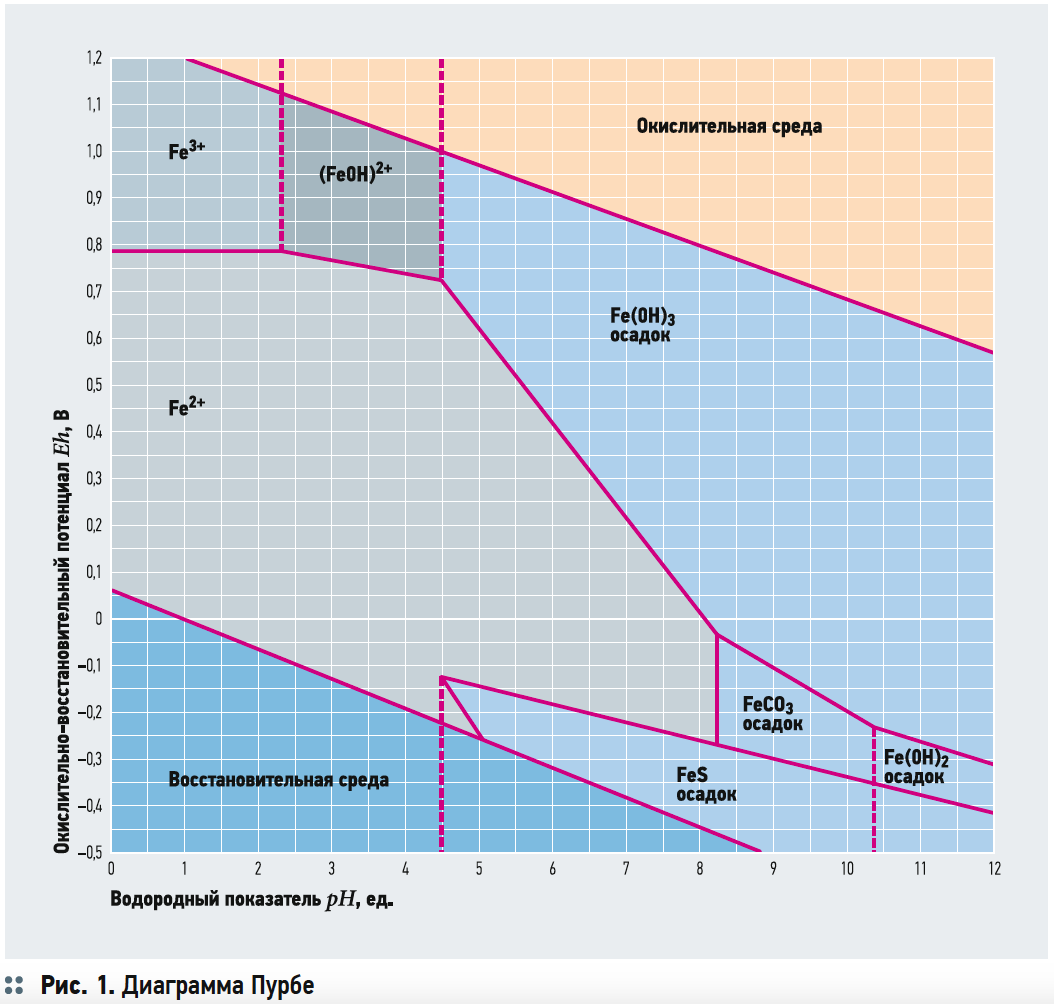
Диаграмма Пурбе для железа (рис. 1) во многих изданиях и справочниках по водоподготовке обычно сопровождается пояснениями, что при рН < 4,5 железо находится в воде в виде ионов Fe3+, Fe2+ и Fe(OH)2+ ; повышение рН приводит к окислению железа (II) в железо (III), которое выпадает в осадок; в восстановительной среде в присутствии карбонатов и при рН < 8,4 возможно выделение карбоната железа и т.п. А затем ниже по тексту приводится уравнение (1), часто с пояснением, что на окисление 1 мг железа (II) расходуется 0,143 мг растворённого в воде кислорода, исходя из стехиометрического соотношения (2 × 16)/(4 × 55,8) = 0,143, где 16 — атомная масса кислорода, 55,8 — атомная масса железа.
Отсюда становится неясным: окисление железа (II) происходит за счёт подачи и растворёния кислорода в обрабатываемой воде или за счёт изменения рН и Eh? А если эти процессы происходят совместно, то каков вклад каждого из них?
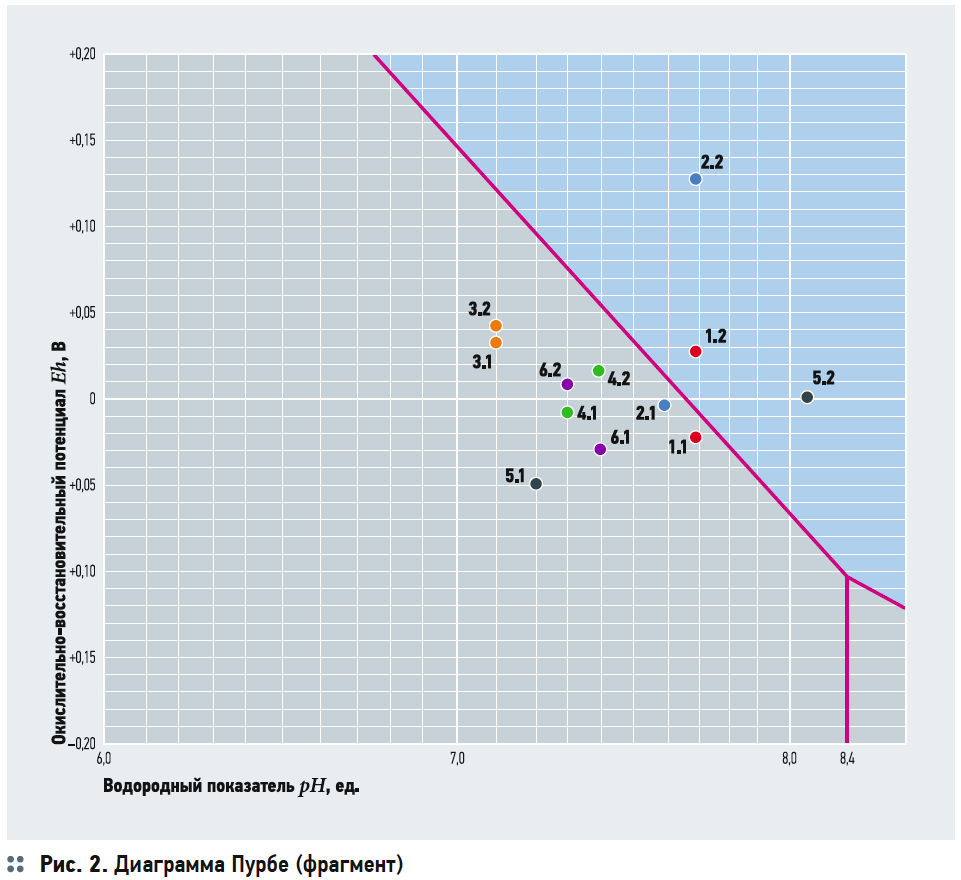
На рис. 2 представлен фрагмент диаграммы Пурбе для железа с нанесёнными на него точками с координатами рН и Eh из табл. 1. Для удобства все пары опытных точек (исходная и очищенная вода) показаны разными цветами. Из рис. 2 следует, что большая часть точек находится в области двухвалентного железа, которое гидролизуется очень слабо.
В опытах 3, 4 и 6 и исходная, и очищенная вода не выходили из этой области, что, однако, не помешало получить высокую эффективность обезжелезивания (содержание железа снизилось в 2,3–6,9 раз), которая мало отличается от эффективности, когда наблюдался переход в область Fe(OH)3. Хотя во всех случаях исходная вода имела рН и Eh, характерные для области Fe2+, основная часть железа находилась в трёхвалентной форме. При этом даже в исходной воде (не говоря уж об очищенной) всегда наблюдался значительный избыток растворённого кислорода по сравнению с принятым стехиометрическим соотношением 1 мг Fe2+ на 0,143 мг О2. Это указывает на то, что процесс окисления значительно ускоряется (или вовсе становится возможным) не в свободном объёме воды, а на границе раздела фаз «вода–воздух» при образовании воздушных пузырьков вследствие аэрации, что было убедительно показано в работе [17] — редкий случай, когда действительно были получены новые ценные знания в области водоподготовки).
Противоречие между наличием в воде растворённого кислорода и низкими значениями рН и Eh объяснимо с той точки зрения, что сама диаграмма Пурбе лишь показывает термодинамически устойчивые формы существования химических элементов при различных значениях pH и Eh, поэтому расположение расчётной точки с координатами рН и Eh в области преобладания Fe(OH)3 вовсе не предполагает, что при этом полностью отсутствуют ионы Fe2+.
Это следует из уравнения Нернста, которое для некой химической реакции
bB + dD ↔ fF + qQ (14)
записывается в виде:
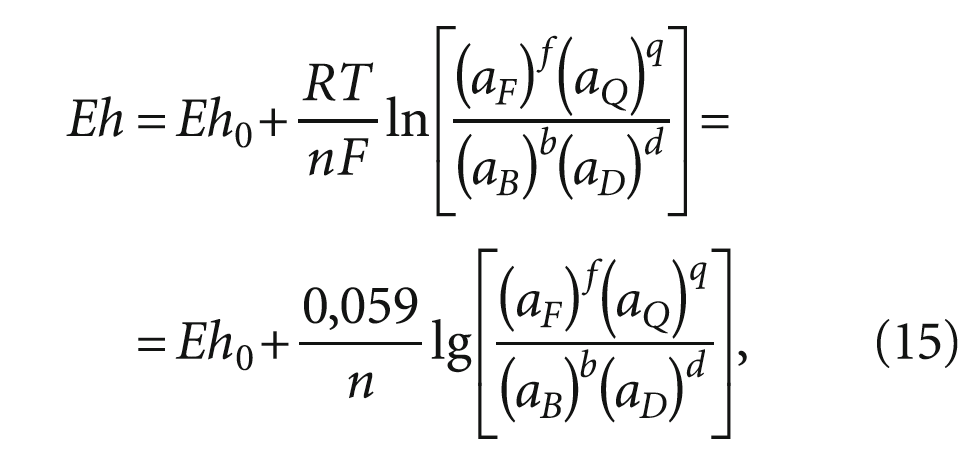
где Eh0 — стандартный электродный потенциал; R — универсальная газовая постоянная, R = 8,31 Дж/(моль·K); T — абсолютная температура, Т = 298 К для стандартных условиях реакции; F — постоянная Фарадея, равная 9,65 × 105 Кл/моль; n — число электронов, участвующих в процессе; aF, aQ, aB и aD — активности, соответственно, окисленной и восстановленной форм вещества, участвующих в реакции.
Данный факт (что в воде одновременно содержатся ионы в окисленной и восстановленной формах) почему-то не находит своего отражения в специальной литературе по водоподготовке.
Таким образом, можно с уверенностью утверждать, что теоретическое обоснование процесса обезжелезивания является в многом умозрительным: отдельные опытные результаты часто противоречат друг другу и не согласуются в рамках единой теории. Поэтому каких-либо более или менее точных расчётных формул, основанных на физико-химических закономерностях, к настоящему времени, к сожалению, не создано.
Если сравнить описания процесса обезжелезивания в работах [13] и [16], то можно увидеть, что они практически совпадают, хотя написаны с разницей в более чем полвека! Это означает, что теория за такой значительный период мало продвинулась вперёд. Часто упоминаемая в литературе роль катализаторов процесса обезжелезивания (ионов марганца, меди, фосфат-ионов, активной плёнки из ранее выпавшего осадка гидроксида железа, каталитически активных загрузок — алюмосиликатных и прочих) также не получила внятного описания.
Слабое теоретическое обоснование, противоречивые факты не позволяют утверждать, насколько различно протекают обезжелезивание и сопутствующие процессы при рН до и после 6,8.
В статье Д. Ф. Янченко [4] приведены данные о существенном снижении в очищенной воде жёсткости, содержания марганца, меди, алюминия, а также ряда анионов: сульфатов, хлоридов, нитратов.
По нашим данным, значительного снижения общей минерализации (соответственно и снижения концентрации отдельных ионов) не наблюдалось. Утверждение о влиянии ионной адсорбции на снижение солесодержания представляется спорным хотя бы по той причине, что, по сведениям Д. Ф. Янченко, наблюдалось одновременное задержание и катионов, и анионов. Скорее, здесь речь должна идти о более разнообразных механизмах, которые отличаются для отдельных ионов, но сводятся к двум процессам: образованию частиц нерастворимого осадка, который задерживается затем в фильтрующей загрузке, и ионному обмену на поверхности как зёрен фильтрующей загрузки (если она обладает обменными свойствами), так и образовавшегося осадка из Fe(OH)3.
Рассмотрение процессов, сопутствующих обезжелезиванию, слишком сложно и обширно, чтобы могло уместиться в рамках данной статьи. Этой теме должны быть посвящены отдельные исследования и публикации. Выделим, например, такой факт, что, согласно данным Д. Ф. Янченко, можно утверждать, что обезжелезивание сопровождается одновременно процессами и нитрификации, и денитрификации при очень низком содержании органических веществ, аэробной среде и малом количестве бактерий.
Выводы
1. Процесс обезжелезивания до сих пор является малоизученным, несмотря на исключительно большое количество работ, посвящённых ему.
2. Процесс обезжелезивания является комплексным: помимо снижения концентрации железа изменяются и другие показатели качества воды: жёсткость, рН, щёлочность, минерализация, окисляемость; механизмы этих изменений различны для отдельных показателей и нуждаются в отдельных исследованиях.
3. Помимо указанных выше показателей в пробах исходной и очищенной воды следует определять содержание растворённого кислорода и окислительно-восстановительный потенциал Eh.
4. В качестве задач последующих исследований процесса обезжелезивания можно выделить следующие:
- уточнить, происходит ли обезжелезивание в одну стадию (одновременное окисление Fe2+ до Fe3+ и гидролиз) или в две стадии (сначала окисление, затем гидролиз), и при каких условиях;
- количественно оценить, насколько влияют катализаторы (ионы марганца, фосфат-ионы, активная плёнка из ранее выпавшего осадка гидроксида железа, каталитически активные загрузки и т.п.) на процесс обезжелезивания;
- изучить возможность более широкого использования диаграммы Пурбе для практических инженерных расчётов.

























