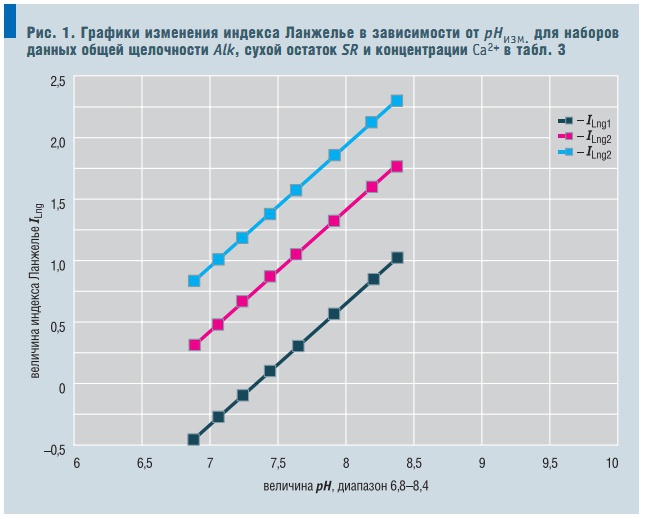
Рис. 1. Графики изменения индекса Ланжелье в зависимости от рНизм. для наборов данных общей щелочности Alk, сухой остаток SR и концентрации Са2+ в табл. 3
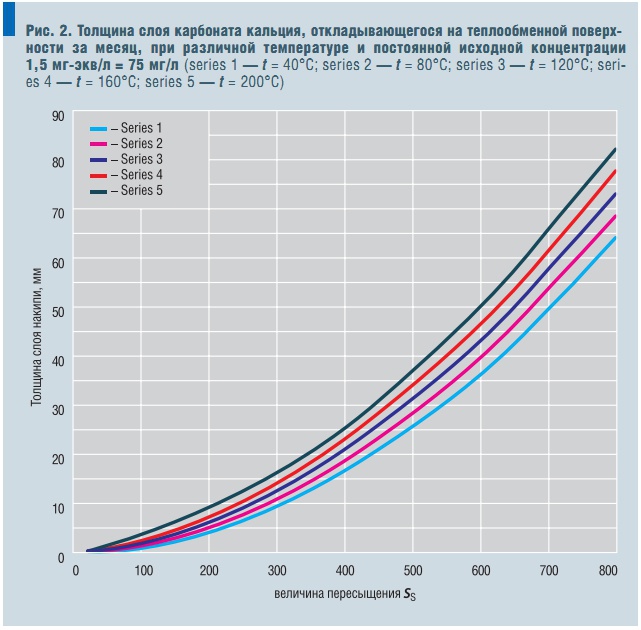
Рис. 2. Толщина слоя карбоната кальция, откладывающегося на теплообменной поверхности за месяц, при различной температуре и постоянной исходной концентрации 1,5 мг-экв/л = 75 мг/л
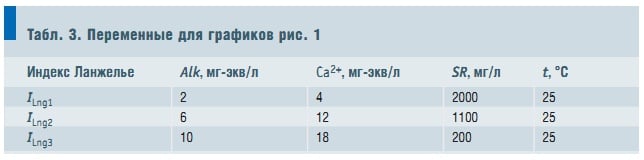
Табл. 3. Переменные для графиков рис. 1
3.2. Дальнейшее развитие метода оценки коррозионно-накипных свойств природной воды
Сложность расчетов индекса Ланжелье привела к тому, что за последние 60 лет предпринимались неоднократные попытки упростить и усовершенствовать метод, предложенный им.
3.2.1. Индекс стабильности Ризнара (ИСР)
Индекс стабильности Ризнара (ИСР) является попыткой учесть эмпирические данные о наблюдаемой толщине отложений в городских водопроводных сетях. Также как и индекс Ланжелье, ИСР основывается на учете концентрации растворенного вещества. Ризнар предлагает определять соотношение между растворимостью карбоната кальция и образованием накипи. Индекс Ризнара рассчитывается по уравнению:
ИСР = 2 × (pHCaCО3 ) – pHизм. , (17)
где pHCaCО3 — значение активности ионов водорода в насыщенном растворе карбоната кальция; pHизм. — измеряемая активность ионов водорода в анализируемой воде. Выводы из оценки ИСР по уравнению (17):
- ИСР < 6— вода склонна к образованию отложений. Эта склонность возрастает по мере уменьшения значения ИСР;
- ИСР > 7 — карбонат кальция откладывается, но поверхность стали от коррозии не защищает;
- ИСР > 8 — с ростом величины ИСР пропорционально возрастает интенсивность коррозии.
3.2.2. Индекс Паккориуса для оценки способности воды к накипеобразованию (ИНП)
Некоторые методики расчетов коррозионно-накипных индексов не учитывают два критических параметра: буферную емкость воды и максимальное количество осадка, которое может образовывать природная вода в равновесных условиях. Индекс накипеобразующей способности Паккориуса позволяет измерить соотношение между насыщенным состоянием и накипеобразованием, учитывая буферную емкость воды.
Вода, богатая кальцием, но с низкой общей щелочностью (ОЩ) и низкой буферной емкостью, может иметь высокую растворимость кальцита. Концентрация кальция растет с ростом произведения активности ионов. Зависимость произведения активности ионов от количества выпадающего из воды осадка сопровождается ощутимым снижением рН по мере как осаждения кальция, так и по мере снижения буферной емкости раствора.
Даже незначительное снижение концентрации карбонат-иона в воде сильно уменьшает произведение активности ионов. И наоборот, даже незначительный рост концентрации карбонатиона приводит к осаждению кальцита. Вода при пересыщении по карбонату кальция, но не обладающая буферной емкостью, неспособна поддерживать рН, при котором образуется кальцит. Индекс накипеобразующей способности Паккориуса расчитывается так же как и индекс стабильности Ризнара. Для учета влияния буферности системы Паккориус используют при расчетах равновесное рНэкв. , а не измеренное рНизм. :
ИНП = 2 × (pHCaCО3 ) – pHэкв. , (18)
где pHCaCО3 — значение активности ионов водорода в насыщенном растворе карбоната кальция; рНэкв. — равновесная активность ионов водорода: рНэкв. = 1,465 × lg(Alk) + 4,54, где Alk — общая щелочность:
Alk = [HCO3 – ] +2 × [CO3 2– ] + [OH– ]
(квадратные скобки — символ равновесной концентрации).
3.2.3. Индекс Ларсона-Скольда (ИЛС)
Индекс Ларсона-Скольда (ИЛС) [5] характеризует коррозионную способность воды по отношению к низкоуглеродистой стали и стальным образцам. ИЛС разработан на основе многолетних наблюдений коррозии трубопровода из низкоуглеродистой стали, по которому транспортируется вода Великих Озер (на границе США и Канады).
Индекс Ларсона-Скольда представляет собой отношение суммы эквивалентных концентраций хлорионов (Cl – ) и сульфат-ионов (SO4 2– ) к сумме эквивалентных концентраций гидрокарбонат-ионов и карбонат-ионов: ИЛС = (CCl – + CSO4 2–) /(CHCO3 2– + CCO3 2–). (19) ИЛС устанавливает причинную взаимосвязь между обычными скоростями коррозии и резкими повышениями ее скорости, которые наблюдаются в воде Великих Озер.
Экстраполяция этих данных на воды других источников, как с низкой, так и с крайне высокой щелочностью, неправомочна. ИЛС — испытанный полезный инструмент в предсказании коррозионной агрессивности охлаждающей воды в водооборотных циклах. Учитывая огромные объемы воды Великих Озер, используемой для охлаждения, особый интерес ИЛС представляет в случае применения ингибиторов коррозии, механизм действия которых основан на использовании естественной щелочности и пленкообразующей способности охлаждающей воды. ИЛС интерпретируется следующим образом способом:
- ИЛС < 0,8 — хлориды и сульфаты не влияют на естественное образование защитной пленки;
- 0,8 < ИЛC < 1,2 — хлориды и сульфаты затрудняют образование защитной пленки. Наблюдается более высокая, в сравнении с нормальной, скорость коррозии стали;
- ИЛС > 1,2 — высокая скорость точечной коррозии по мере повышения значения индекса.
3.2.4. Индекс Стиффа-Девиса (ИСД)
Индекс Стиффа-Дэвиса [6] является попыткой преодолеть недостатки индекса Ланжелье в случаях, когда концентрация солей жесткости в воде высокая и эффекта «общего иона» оказывает влияние на движущую силу образования отложений. Подобно ИЛС, ИСД базируется на концепции растворимости. Произведение растворимости, используемое для расчетов рН насыщенного раствора (pHS), эмпирически преобразовано в ИСД. ИСД показывает более низкую способность воды к образованию накипи, чем индекс Ланжелье в тех же условиях и при том же составе воды. Разница между показаниями индексов возрастает по мере роста ионной силы раствора. Интерпретация ИСД проводится по той же самой шкале, что и при расчетах индекса Ланжелье.
3.2.5. Индекс Оддо-Томсона (ИОТ)
Индекс Оддо-Томсона [7] позволяет оценивать влияние импульсных давлений и парциального давления СО2 на pH воды и растворимость карбоната кальция. Эта эмпирическая модель также учитывает поправки на присутствие двух или трех фаз (вода, газ, и нефть). Интерпретация индекса ведется по той же шкале, что и в ИЛС и ИСД.
4. Упрощенный расчет индекса Ланжелье
Как уже было отмечено ранее, расчет индекса Ланжелье достаточно сложен для не специалиста. Вполне естественно, что попытки упростить его предпринимались неоднократно. Отметим, что значения коэффициентов активности однои двухзарядных ионов, а затем и ионной силы раствора, определяются только их зарядом и концентрацией, но не химическими свойствами. Уместно напомнить, что мыобсуждаем варианты расчета для очень слабого раствора, в котором коэффициенты активности близки к единице.
Например, верхний предел применимости уравнения (2) ограничен концентрацией карбоната кальция 8,5 мг-экв/л или приблизительно 0,04%. В 2%-м растворе соляной кислоты, в 5%-м растворе серной и азотной кислот активность воды порядка 0,98. В 2%-м растворе карбоната натрия активность воды порядка 0,99, а карбоната калия—0,995. Поскольку индекс Ланжелье скорее качественный, чем количественный показатель, задачу расчета можно существенно упростить.
Можно заменить расчет ионной силы и коэффициентов активности ионов различного заряда измерением массы «сухого остатка», то есть общей массы всех солей, остающихся в пробе раствора после выпаривания. В этом случае не надо делать полный количественный химический анализ пробы воды. Достаточно просто высушить определенный объем воды и измерить взвешиванием массу осадка. Более того, массу растворенных в единице объема веществ легко и быстро можно установить с помощью уравнений (1) или (2) по электропроводности раствора, как это описано в разделе 2.1.
Следующий шаг на пути облегчения расчета индекса Ланжелье позволяет сделать и анализ математической модели, полученной регрессионным анализом. На базе экспериментальных данных о значениях индекса Ланжелье построена математическая модель в зависимости от следующих параметров: рН раствора; температуры t, при которой ведется измерение рН; общей щелочности Alk (см. табл. 2, «С.О.К.» №6/2005); концентрации иона кальция; массы растворенных в единице объема веществ — сухого остатка SR после выпаривания.
ILng = (–8,19 + 0,088 × Alk – – 4,69 × 10–8 × SR2) + 0,118 × Ca2+/pH + + (1,15 – 0,138/Ca2+ – 1,18/ t) × pH. (20)
Коэффициент множественной корреляции R2 = 0,997; среднеквадратичное отклонение расчетного значения индекса Ланжелье по модели (20) составляет s = ±0,04. Общая щелочность Alk и кальциевая жесткость Са2+ выражены в мг-экв/л, сухой остаток (SR) после выпаривания пробы воды выражен в мг/л. Температура измеряется в °С. Уравнение адекватно в следующих диапазонах изменения переменных:
- Alk, мг-экв/л — 2–10;
- Са2+, мг-экв/л — 2–22;
- SR, мг/л — 200–2000;
- t, °С — 14–36;
- pH — 6,8–8,4.
Подчеркну, что в уравнении используется измеренное с помощью рН-метра значение рНизм. , но индекс Ланжелье мы расчитываем по уравнению (20) сразу с ошибкой ±0,04 ед. измерения рН. Уравнение (20) почти линейно:
ILng = А + В × рНизмер.+ D/pHизмер. , (21)
где:
А = (–8,19 + 0,088 × Alk – 4,69 × 10–8 × SR2);
B = (1,15 – 0,138/Ca2+ – 1,18/t);
D = 0,188 × Ca2+.
Некоторую нелинейность ему придает слагаемое D/pHизмер. . На рис. 1 представлены графики зависимости ILng от рНизмер. , расчитанные для следующих наборов значений независимых переменных (табл. 3). Графики иллюстрируют:
- отрицательные значения индекса Ланжелье фактически определяются численным значением свободного члена А уравнения (21), что наиболее наглядно для набора данных ILng1;
- визуально тангенс угла наклона уравнения (21) почти не меняется, а слагаемое D/рНизмер. в заданном диапазоне значений рН практически не вносит кривизны.
Оценка численных значений слагаемого D/рН показывает, что они меняются в диапазоне 0,1–0,5, составляя по всему набору данных в среднем 0,3. Еще меньше изменяется тангенс угла наклона B уравнения (21). Его численное значение меняется в диапазоне 1,06–1,10 при изменении температур измерения рН от 15 до 35°С, составляя по всему набору данных в среднем 1,08.
Поскольку индекс Ланжелье является качественной характеристикой свойств воды, мы можем считать D/рН постоянной величиной, равной 0,3, а коэффициент В— константой, равной 1,08. За счет этого уравнение для вычисления индекса Ланжелье становится еще проще, а для оценки коррозионно-накипных свойств воды нам достаточно выполнить только три измерения: общей щелочности Alk, сухого остатка SR после выпаривания пробы воды и рНизм. :
ILng = (–7,89 + 0,088 × Alk – 4,69 × 10–8 × SR2) + 1,08 × pH. (22)
Вспомним, что оценить содержание cухого остатка (SR) в воде позволяет уравнение (2) (см. раздел 2.1) по результатам измерения электропроводности воды. Таким образом, для оценки индекса Ланжелье — способности воды вызывать коррозию или образовывать накипь — требуется два инструментальных измерения: рН и электропроводности, а также выполнение только одного химического анализа общей щелочности Alk.
5. Оценка накипеобразующей способности воды
Основное вещество, образующее кристаллические осадки на трубопроводах, теплообменных поверхностях котлов и бойлеров, — карбонат кальция, практически всегда содержащийся в воде природных источников. Такая вода— наиболее дешевый и доступный теплоноситель. Поэтому в дальнейшем мыбудем говорить именно о кристаллизации карбоната кальция.
Для карбоната кальция характерна обратная зависимость растворимости от температуры. Это означает, что с ростом температуры растворимость карбоната кальция SCaCO3 не растет, как у большинства солей, а снижается. Поскольку наиболее высокая температура наблюдается на теплообменной поверхности, именно в приповерхностном слое самое высокое пересыщение и самая высокая скорость образования и роста кристаллов карбоната кальция. Рассчитать растворимость карбоната кальция в воде SCaCO3 с точностью ±1,5 мг/л в диапазоне температур 20–200°C позволяет уравнение, ранее опубликованное в [4]:
SCaCO3 = [6,723 × t × exp(–0,05064 × t)]0,5, (23)
где t — температура, °С. По сути это уравнение (12), в котором концентрация выражена в мг-экв/л. Движущей силой процесса кристаллизации является пересыщение SS, то есть превышение фактической концентрации растворенного вещества — в данном случае карбоната кальция — над его растворимостью:
SS = CCaCO3 /SCaCO3 , (24)
где CCaCO3 — фактическая концентрация карбоната кальция в растворе, мг/л. Ранее при вычислении индекса Ланжелье мыиспользовали измерение массысухого вещества SR, содержащегося в единице объема воды. Эта величина представляет собой сумму концентраций карбоната кальция, обеспечивающего насыщение раствора по данной соли при данной температуре, и остальных растворенных солей. Поскольку нас интересует только карбонат кальция, его долю в общей массе растворенных сухих веществ позволяет учесть соотношение:
DCaCO3 = 2,5 × [Ca2+] /SR , (25)
в котором все концентрации выражены в мг/л. Пересыщение по карбонату кальция в воде, в которой растворены различные соли, можно оценить по уравнению, которое получается в результате подстановки в уравнение (24) уравнений (23) и (25):
SS = [DCaCO3 × SR] / [SCaCO3 (t)] = [DCaCO3 × SR] / [6,723 × t × exp(–0,05064 × t)]0,5. (26)
Известно, что при росте температуры объем воды увеличивается, следовательно концентрация как масса растворенного, отнесенная к объему, снижается. Однако этот факт становится ощутимым только при высоких температурах. Так, например, если при 100°С объем воды увеличивается по сравнению с номинальным при 0°С на 4,3%, то при 250°С он больше уже на 26%.
Поскольку уравнение (23) позволяет рассчитывать концентрацию карбоната кальция до 200°С, есть смысл при расчете пересыщения в уравнение (26) внести коэффициент увеличения относительного объема воды с ростом температуры. Приведенное ниже уравнение получено на основе справочных данных, и представляет собой температурную зависимость отношения объема воды Vt0 при 0°С к объему воды Vti при i-той температуре:
Vt0/Vti = 1,028 – 8,330 × 10–4 × t, R2 = 0,9969; s = ±0,014. (27)
Уравнение (27) справедливо в диапазоне температур от 0 до 250°С. После подстановки его в уравнение (26) появляется возможность вычислять пересыщение по карбонату кальция с учетом температуры, до которой нагрета вода:
SS(t) = (1,028 – 8,330 × 10–4 × t)× DCaCO3 × SR/ [6,723 × t × exp(–0,05064 × t)]0,5. (28)
Напомним, что концентрацию сухих веществ в воде в мг/л позволяет вычислить уравнение (1) по данным об электропроводности.
SR = λ×(0,401 + + 2,21 × 10–5 ×λ) . (29)
Таким образом, пересыщение по карбонату кальция может быть вычислено по данным двух инструментальных измерений: электропроводности и температуры воды в зоне кристаллизации.
5.1. Оценка толщины слоя накипи
Попытаемся оценить толщину слоя накипи по данным о пересыщении и температуре воды на теплообменной поверхности или поверхности трубопровода. Лимитирующей стадией процесса кристаллизации является зародышеобразование. Если кристаллический зародыш образовался, то при наличии пересыщения до конечных размеров он растет достаточно быстро. Из теории кристаллизации следует, что частота гетерогенного зародышеобразования Iget (количество кристаллических зародышей, образующихся на единице поверхности в единицу времени) описывается уравнением [8].
Iget = Kget × exp[–A × 1/ln2(SS)] , (30)
где Kget — частота образования кристаллических зародышей на единице поверхности в единицу времени при бесконечно большом пересыщении SS.
A = (16 ×π)/3 × [M/(ρS × NA)]2 × × [σ/(k × T)]3 × f(Θ) , (31)
где М — молекулярная масса кристаллизующегося вещества; NA — число Авогадро, т.е. количество молекул в одной граммолекуле; ρS — удельный вес (плотность) кристаллизующегося вещества; k — постоянная Больцмана; Т — температура в градусах Кельвина; σ— поверхностное натяжение на границе кристаллический зародыш/твердая поверхность; f (Θ)— функция угла смачивания твердой поверхности кристаллическим зародышем. Для дальнейших вычислений удобнее будет переписать уравнение (30) в следующем виде, выведя температуру из константы в переменную величину:
Iget = Kget × exp[–(B/T)3 × 1/ln2(SS)] , (32)
где B = (16 ×π)/3 × [M/(ρS × NA)]2 × ×(σ/k)3 × f (Θ). (33)
По данным наблюдений за толщиной слоя накипи, которая отложится за месяц на теплообменной поверхности, используя форму ее зависимости от пересыщения и температуры, предсказанную теорией, из уравнения (32) определим известными приемами (линеаризация и метод наименьших квадратов) [9] численные значения коэффициентов Kget, В:
d = 172 × exp[–8,57 × 109/(273 + t)3 × 1/ ln2(SS)]. (34)
Зная величину пересыщения (28) и температуру t на поверхности, возможно вычислить толщину слоя накипи, которая может отложиться за один месяц. Данная оценка может оказаться завышенной. Дело в том, что скорость образования накипи в значительной мере определяется материалом поверхности и ее состоянием. Как было показано в [4], на стали карбонат кальция в принципе не должен образовывать отложения, т.к. кристаллографическое несоответствие его кристаллов к кристаллам стали слишком велико.
Но как только на поверхности образуется гематит или сидерит (оксид железа, карбонат железа), на этом слое сразу же начинается кристаллизация карбоната кальция. Вот почему питательную воду котлов рекомендуют дегазировать — освобождать от растворенного кислорода и двуокиси углерода. Кроме того, как только на поверхности откладывается даже небольшой слой накипи, теплопередача в этом месте существенно ухудшается и, как следствие, падает температура, снижается пересыщение.
Другими словами, скорость отложений во времени в принципе не может быть постоянной величиной. Это следует все из тех же уравнений (28) и (34). Кроме того, как было показано в статье [4], скорость кристаллизации на поверхности зависит от термодинамического состояния раствора. Поскольку учесть все факторы, определяющие скорость кристаллизации и их взаимовлияние, практически невозможно, предлагается уравнение (34) рассматривать как оценочное, качественное.
Так же, как и индекс Ланжелье. Если по уравнению (34) построить графики толщины отложившегося за месяц слоя накипи при различных температурах и исходных концентрациях карбоната кальция в воде, то мы получим набор кривых. Как следует из уравнений (28) и (34), температура очень неоднозначно влияет на процесс накипеобразования. Повышение температуры снижает растворимость карбоната кальция, увеличивая пересыщение по этой соли, но одновременно увеличивается объем раствора и тем самым снижается концентрация.
Температура очень сильно (в третьей степени) влияет на скорость образования и роста кристаллов. Что касается исходной концентрации карбоната кальция в воде, то она, как следует из уравнений (26) и (34), нелинейно влияет на скорость отложений. Учитывая все это, мы попытались обобщить результаты вычислений по уравнению (34), «проиграв» все возможные варианты и построив по ним регрессионную модель:
D = –1,1 + 0,001 × SS × × [0,142 × t – 4,83 × 10–3 × SS + 560 × SS/C0 2 ]. (35)
Размерность толщины слоя накипи d, как и в уравнении (34), —мм/мес, SS — пересыщение, C0 = CCaCO3 = D × SR — исходная концентрация карбоната кальция в воде при комнатной температуре. Таким образом, сделать прогноз о толщине отложений, которые могут образоваться на поверхности за месяц, можно всего лишь измерениями температуры поверхности и электропроводности при комнатной температуре омывающей ее воды.
Для наглядности кривые толщины слоя накипи, откладывающейся на теплообменной поверхности за месяц, при C0 = 0,5 мг/л или 1,5 мг-экв/л, показаны на рис. 2. Таким образом, в главе 4 и 5 автор предлагает дальнейшее усовершенствование индекса Ланжелье и метод прогнозирования толщины образующегося слоя накипи в зависимости от пересыщения и температуры. Диагностика никогда не лечит, но указывает путь к выздоровлению.
Чтобы избавиться от коррозии и одновременно не спровоцировать образование накипи, необходимо индекс Ланжелье, как следует из рис. 1, поддерживать близким к нулю, т.е. в диапазоне от –0,4 до +0,4. Как следует из уравнения (22), при условии ILng = 0 это возможно, если:
pH = 7,306 – 0,0815 × Alk + + 4,343 × 10–8 × SR2. (36)
В широком диапазоне значений общей щелочности Alk и содержания сухих веществ SR в пробе воды после выпаривания близкое к нулю значение индекса Ланжелье обеспечивается при рН = 6,95–7,05. Практические рекомендации очевидны: если рН больше 7,05, воду необходимо подкислить, если рН ниже 6,95, воду надо подщелачивать. Почти такой же результат обеспечивает удаление растворенных веществ (SR = 0) или общей щелочности (Alk = 0).
Напомним, что как правило общая щелочность совпадает с карбонатной жесткостью воды. Что касается снижения способности воды к накипеобразованию, то, как следует из уравнений (34) и (35), надо принимать меры по снижению пересыщения до 1. То есть концентрацию карбоната кальция в воде снижать до уровня растворимости при данной температуре.
























