
Рис. 1

Рис. 2
1. ВОДА И ЕЕ ПРИМЕНЕНИЕ
Вода — наиболее распространенное, доступное и дешевое вещество. В воде зародилась жизнь, вышла из нее, постепенно заселив сушу и воздух. Без воды немыслима жизнь на планете Земля, немыслима жизнедеятельность человека. Именно доступность и незаменимость воды обусловила ее широкое применение в быту, промышленности и сельском хозяйстве, медицине — во всех сферах человеческой деятельности. Трудно вспомнить, где вода не применяется. Но именно это и создает проблемы, связанные с ее подготовкой к использованию, с ее очисткой.
Вода в природе
Вода — жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая); плотность r = 1,000 г/см3 (при 3,98°C), Tплавл. = 0°C, Tкип. = 100°C. Одно из самых распространенных веществ в природе. Гидросфера занимает 71% биосферы. Биосфера, включающая всю совокупность живых организмов и ту часть вещества планеты, которая находится в непрерывном обмене с этими организмами, ничтожно тонка — от глубин океанских впадин до высот снежных вершин слой биосферы достигает толщины всего 20 км, что составляет лишь 0,3% радиуса Земли. К тому же эта обетованная пленка на поверхности Земли в основном водная, и в этом смысле наша планета является планетой Воды. Заглянем в «Словарь» Брокгауза и Ефрона: «минерал» (от mina — подземный ход, штольня) — это название дают однородным твердым или жидким неорганическим произведениям природы, определенного химического состава, входящим в состав твердой оболочки земли, а также и других небесных тел. Таким образом, жидкая вода — жидкий минерал, твердая вода (лед) — твердый минерал. В последние десятилетия обнаружены большие запасы топлива в виде твердых кристаллогидратов природных углеводородов. Вода — прекрасный растворитель и потому невозможно встретить в природе жидкую «чистую» воду, то есть воду, в которой не растворены неорганические и органические вещества. Вода — прекрасная среда обитания живых организмов и потому невозможно встретить в природе «чистую» воду, т.е. воду, в которой бы не обитали микробы, бактерии, моллюски, рыбы и т.д.
Вода и человек
Столь универсальный по свойствам и широте распространения минерал нашел чрезвычайно широкое использование в жизнедеятельности человека. Вода используется в быту, в промышленности, в сельском хозяйстве — где угодно. Приведу примеры того, в каких объемах используется вода. В теплоэнергетике вода — теплоноситель и рабочее тело. Тепловые электростанции используют на производство одного гигаватта электроэнергии 32–42 м3 в секунду воды [1]. В частности, на охлаждение конденсатора турбины только одного энергоблока используется от 6 до 10 тыс. м3/ч. Если учесть, что в 1990 г. СССР произвел 1,726 млрд ГВт•ч электроэнергии, а к 2010 г. планировал увеличить производство электроэнергии только на ТЭС на 50–55% [2], то можно считать, что развал СССР, резкое падение производства и значительное снижение объемов производимой электроэнергии спасли республики бывшего СССР от экологической катастрофы. В металлургии вода используется для охлаждения оборудования, как теплоноситель и как рабочее тело для ТЭС, которые есть на каждом металлургическом комбинате, но не относятся к Министерству энергетики. То есть, не учтены в вышеприведенных цифрах. Только на охлаждение одной доменной печи используется до 10 тыс. м3/ч. В химии вода — растворитель; один из реагентов некоторых химических реакций; «транспортное средство», то есть среда, позволяющая перемещать реагенты, продукты реакции из одного технологического аппарата в другой; теплоноситель и хладагент в тепловых процессах. В конечном итоге, вывод в окружающую среду жидких отходов производства осуществляется тоже в виде водных растворов и суспензий. Указать общие объемы воды, используемой химической промышленностью, не представляется возможным. Чтобы иметь хоть какое-то представление об объемах используемой воды и водных растворов, укажу, что только содовые заводы СССР выпускали в год свыше 1 млн т кальцинированной соды, а на производство 1 т кальцинированной соды (только в виде раствора хлорида натрия — рассола) расходовалось 5,5 м3 рассола. Потом в технологическом процессе этот объем увеличивался приблизительно в два раза и выводился в виде жидких отходов. Перемножить между собой эти цифры сможет сам читатель. В медицине вода — растворитель, лекарственное средство, средство санитарии и гигиены, «транспортное средство». Повышение уровня медицинского обслуживания и рост народонаселения планеты Земля естественным образом ведет к росту водопотребления на медицинские цели. В сельском хозяйстве вода — транспортное средство питательных веществ к клеткам растений и животных, участник обменных реакций, участник процесса фотосинтеза, реакций гидролиза, регулятор температуры живых организмов. Объемы воды, которые затрачиваются для полива сельскохозяйственных растений, при кормлении животных, птицы, не уступают объемам, используемым промышленностью. Для примера укажу, что потребление воды свиньей составляет 0,004–0,010 м3 на килограмм сухого корма. Но свинью надо не только поить, но и купать. Если говорить о корове, то кроме того, что корове надо «запить» сухой корм, следует вспомнить, что «буренка» нормальной производительности дает 4 м3 молока в год только в лактационный период. И, как минимум, этот объем воды ей надо предоставить. Овцы, кони, куры, утки и гуси тоже пьют. А теперь умножте вышеприведенные цифры на поголовье сельскохозяйственных животных и птицы, чтобы понять масштабы проблемы сельскохозяйственного водоснабжения. В быту вода — средство санитарии и гигиены, участник химических реакций, протекающих при приготовлении пищи, теплоноситель, транспортное средство, удаляющее продукты жизнедеятельности человека в канализацию. Норма водопотребления на одного человека существенно разная по отдельным городам. Так, например, в Санкт-Петербурге она — 0,70 м3/мес, в среднем по Украине — 0,32 м3/мес, а в Европе — 0,11 м3/мес. Вспомните о приблизительно 6 млдр человек, населяющих планету Земля и вам станет ясно, почему время от времени возникают разговоры о все возрастающих проблемах с питьевой водой даже в «мокрых» регионах планеты.
Что такое «чистая» вода?
Понятно, что для минерала, происходящего из разных месторождений, раз-ного состава и столь широкого диапазона применения не могут быть сформулированы единые требования по «качеству». К сырой воде, то есть воде из источника водоотбора, требования одни. К «очищенной» воде, то есть воде, подготовленной к дальнейшему использованию, требования совершенно другие. Более того, представления о качестве используемой воды с годами меняются, отражая:
- знания о влиянии на живой организм или технологический процесс отдельных компонентов раствора, называемого водой;
- разработанные и освоенные методы анализа;
- уровень развития науки и техники;
- «обратную связь» между потребляемой человеком водой и тем набором растворенных веществ, твердых включений и микроорганизмов, которые сбрасываются в виде сточных вод, жидких отходов промышленного и сельскохозяйственного производства.
Например, лет 200 назад для оценки качества питьевой воды использовались только органолептические* методы: оценка цвета, вкуса, запаха. Сейчас перечень анализов, выполняемых санитарной лабораторией предприятия пищевой промышленности, размещается на двух страницах, заполненных мелким шрифтом. По традиции в таком списке остаются и органолептические показатели качества. Полученные в виде анализа знания о составе воды из источника водоснабжения должны вести к технологическим приемам очистки от тех или иных загрязнений. Так мы естественным образом переходим к обсуждению методов водоподготовки и водоочистки.
Что такое водоподготовка и очистка воды?
Обратимся к справочной литературе. Энциклопедический словарь медицинских терминов сообщает: «Очистка воды (син. очистка природных вод) — комплекс санитарно-технических мероприятий, направленных на удаление примесей, представляющих опасность для человека». Малая медицинская энциклопедия: «Очистка воды — обработка воды с помощью различных технологических приемов (коагуляция, фильтрация и др.) с целью улучшения ее органолептических и физико-химических свойств в соответствии с требованиями ГОСТ — см. «вода». Сельскохозяйственный словарь: «Очистка воды — приведение качества исходной воды в соответствие с требованиями потребителя. Способы очистки воды: осветление (устранение мутности), обесцвечивание (устранение органических веществ), обеззараживание, дезодорация, опреснение, умягчение». Энциклопедия «Москва»: «Очистка сточных вод проводится в Москве для поддержания необходимого уровня благоустройства города и состояния воды в Москве-реке. Очистка сточных вод затруднена в Москве относительно малым дебитом приемника сточных вод — Москвы-реки». Российский энциклопедический словарь: «Водоподготовка — приведение качества воды, используемой в технологических целях на различных промышленных предприятиях, а также в системах водои теплоснабжения и др., в соответствие с требованиями потребителей». Большая Советская Энциклопедия: «Водоподготовка — обработка воды, поступающей из природного водоисточника на питание паровых и водогрейных котлов или для различных технологических целей. Водоподготовка производится на ТЭС, транспорте, в коммунальном хозяйстве, на промышленных предприятиях».
Подведем итог.
Водоподготовкой условились называть приведение качества воды в соответствие с требованиями промышленных предприятий. Очисткой воды, используемой для нужд человека и животных, называют приведением качества воды к нормам, обусловленным соответствующими ГОСТ. Очисткой сточных вод, сбрасываемых промышленными и коммунальными предприятиями, по аналогии назовем приведение состава жидких стоков в соответствие с нормами ПДК (предельно допустимых концентраций). Как уже отмечалось выше, в связи с ростом знаний и ухудшением экологической ситуации как следствием жизнедеятельности человека нормы на потребляемую воду все время пересматриваются. Чтобы им соответствовать, совершенствуются технологии очистки воды, оборудование. Например, фармакопея США (USP) дает определение нескольким типам воды: очищенная вода, вода для инъекций, стерилизованная вода, стерильная вода для инъекций, стерильная бактериостатическая вода для инъекций, стерильная вода для ингаляций и стерильная вода для орошения. USP устанавливает нормы методов стерилизации и расфасовки для отдельных видов используемой воды. Поскольку в принципе физическая и физико-химическая сущность методов очистки в своей основе остается неизменной, но совершенствуются только технические приемы, технические и схемные решения, в настоящей статье мы приведем их «с опережением»: если даже какие-то методы очистки в России широко не используются сегодня, то жизнь заставит использовать их завтра.
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДОВ ВОДОПОДГОТОВКИ И ОЧИСТКИ
Наука исследует свойства вещества, изменение его свойств в процессе химических превращений. Техника на основе известных свойств веществ разрабатывает приемы работы с ними. Прежде чем приступить к изложению применяемых методов водоподготовки и очистки воды, напомним определения физических, физико-химических и биологических явлений, используемых при водоподготовке или очистке воды: фазовые переходы первого и второго рода; коагуляция; гравитация; фильтрование; осмос; адсорбция физическая и химическая; реакции окисления; фотохимические реакции; термическая денатурация белка.
Фазовые переходы
Известны четыре агрегатных состояния вещества: твердое, жидкое, газообразное и плазма — резко отличные по своим свойствам и характеристикам. Однородный в физическом и химическом отношении конечный объем условимся называть фазой. Или, пользуясь определением Гиббса, назовем фазой однородную часть неоднородной системы. Переход из одного фазового состояния в другое называют фазовым переходом. Различают четыре агрегатных состояния вещества, но фазовые переходы могут быть n-го порядка (рода). Классификацию их ввел Пауль Эренфест [3].
Фазовые переходы 1 рода
Фазовые переходы первого рода (ФП1) протекают с изменением агрегатного состояния вещества: плавление–затвердевание (кристаллизация), испарение–конденсация, растворение–кристаллизация, сублимация–кристаллизация. Точка перехода ФП1 характеризуется:
- скачкообразным изменением значений характеристических функций и физических свойств системы;
- наличием разрыва первых производных характеристических функций и свойств системы (теплоемкость, вязкость, плотность, энтропия, энтальпия, изобарно-изотермический потенциал и т.д.) по физическим параметрам (температура, давление, интенсивность электрического, магнитного или гравитационного поля и т.д.);
- наличием области метастабильного состояния.
Кристаллизация — типичный пример фазового перехода первого рода, сопровождающегося изменением агрегатного состояния вещества [4]: жидкое (раствор, расплав) становится твердым. Кристаллизация широко используется при очистке воды и водоподготовке. Вывести загрязняющий воду ион можно, если перевести его в малорастворимое химическое соединение. Кристаллизация — обычный прием очистки водных растворов от ионов кальция, магния, железа, марганца и т.д.:
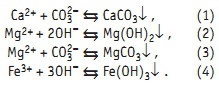
Вода природных источников водоснабжения очень отличается по содержанию солей кальция и магния, так называемых солей жесткости. В речной воде, например, днепровской, суммарная концентрация ионов кальция и магния не превышает 7 мг÷экв/л, в то время как вода рек Невы и Амазонки содержит не более 1,5 мг÷экв/л. В воде артезианских скважин, используемых как источник водоснабжения, суммарная концентрация солей жесткости может доходить до 20 мг÷экв/л, а в морской воде — до 40 мг÷экв/л. Растворимость карбоната кальция, образующегося по реакции (1), при температуре 20°С составляет 0,14 мг÷экв/л. Растворимость гидроокиси магния составляет 1,88 мг÷экв/л, гидроксида железа — 0,007 мг÷экв/л. Магний в водном растворе при наличии карбонат-иона или контакте с углекислотой воздуха образует целый ряд двойных солей и кристаллогидратов очень низкой растворимости. Для карбоната кальция и гидроксида магния характерно снижение равновесной растворимости с ростом температуры. Таким образом, суммарная концентрация ионов кальция и магния, которую в определенных условиях можно получить при очистке воды, при температуре 20°С может достигать 0,16 мг÷экв/л. Это означает, что в процессе очистки воды кристаллизацией в виде малорастворимых соединений суммарную концентрацию кальция и магния можно понизить в днепровской воде в 44 раза, в воде артезианских скважин — в 125, а в морской воде — в 250 раз. Правда, растворимость карбоната кальция в насыщенных растворах хлорида натрия, например, в морской воде Мертвого моря, ощутимо выше. Для осаждения иона кальция к воде надо добавить ион СО32–. Однако в ней всегда присутствует этот ион за счет растворения углекислоты, содержащейся в воздухе. Этот факт используют при очистке методом известкования воды с невысоким содержанием солей жесткости, добавляя известковое молоко. При высоких содержаниях в воде ионов кальция и магния используют известково-содовый метод. Осаждение иона магния по реакции (2) ведут известковым молоком, а иона кальция по реакции (1) и «доосаждение» иона магния ведут хорошо растворимой и хорошо диссоциирующей на ионы кальцинированной содой:
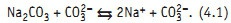
К проблемам, возникающим при очист-ке кристаллизацией, относится характерное для ФП1 и упомянутое выше наличие области метастабильного состояния. Карбонат кальция образует устойчивые пересыщенные растворы. Чтобы как-то сдвинуть вправо процесс, символически отражаемый уравнением (1), надо увеличить концентрацию одного из реагентов: или иона кальция, или карбонат-иона. Если применяется метод известкования, то увеличивают дозировку добавляемого известкового молока. Если используется известково-содовый метод очистки, то увеличивают дозировку кальцинированной соды. В любом случае на последующей стадии добавляемые «избытки» надо удалить. У карбоната кальция есть еще одна неприятная особенность — он предпочитает кристаллизоваться на металлической поверхности технологического оборудования и трубопроводов [4], образуя так называемые солеотложения, или накипь. Как следует из уравнения (4), очистить воду от трехвалентного железа за счет его кристаллизации в виде гидроксида можно, добавляя к воде щелочь, то есть увеличивая рН. Испарение и конденсация — типичные примеры фазового перехода первого рода, сопровождающиеся изменением агрегатного состояния вещества [4]: жидкость превращается в газ (пар), газ конденсируется до жидкого состояния. В природе за счет испарения воды высыхает земля после дождя. Когда водяной пар конденсируется — идет дождь. Испарение с последующей конденсацией образовавшегося пара широко используется при производстве свободной от растворенных примесей воды, но имеющих более высокую температуру кипения. В технике так получают пресную воду из морской воды, так получают дистиллированную воду в больницах, аптеках, лабораториях. Испарение — очень энергоемкий процесс. Испарение идет при любой температуре. Удельная теплота парообразования r в системе СИ выражается в кДж/кг испарившейся жидкости. Зависимость теплоты парообразования (конденсации) от температуры можно описать уравнением:
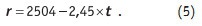
При конденсации выделяется столько тепла, сколько его затрачивается на испарение при той же температуре. Уравнение (5) дает представление об энергозатратах: если при 0°С на испарение килограмма воды потребуется затратить 2504 кДж, то при 100°С энергозатраты на испарение составят 2259 кДж/кг. Из уравнения (5) следуют те «маленькие хитрости», которые используются для снижения энергозатрат на очистку сильно засоленной воды методом дистилляции.
Фазовые переходы 2 рода
Фазовые переходы второго рода (ФП2) протекают без изменения агрегатного состояния вещества и представляют собой структурную перестройку. Примерами ФП2 являются: изменение кристаллографической модификации твердого тела, переход диамагнетика в парамагнетик, сверхтекучесть и сверхпроводимость. В случае ФП2 структурная перестройка происходит именно в точке (точка Кюри, l-точка, критическая точка) и характеризуется:
- скачкообразным изменением значений характеристических функций и физических свойств системы при непрерывном и плавном изменении воздействующих на систему факторов;
- обращением в нуль значений первых производных характеристических функций и свойств системы (энтропия, теплоемкость, энтальпия, изобарно-изотермический потенциал, вязкость, плотность и т.д.) по физическим параметрам (температура, давление, химический потенциал, индукция магнитного, напряженность электрического, частота акустического поля, величина гетерогенной поверхности и т.д.), но наличием разрыва функций вторых производных;
- отсутствием поглощения или выделения тепла системой в критической точке, то есть неизменностью общего числа связей, например, водородных, обеспечивающих взаимодействие между элементами системы: сколько связей рвется при структурной перестройке, столько их и образуется;
- отсутствием области метастабильного состояния, скачкообразным изменением структуры в точке перехода.
ФП2 всегда предшествует ФП1: сначала происходит структурная перестройка в системе, а затем уже начинается изменение агрегатного состояния вещества. Этот факт можно использовать для ускорения процесса кристаллизации, если заставить соль-загрязнитель кристаллизоваться в другой, чем обычно, кристаллографической модификации. Этот факт можно использовать для снижения энергозатрат на испарение воды.
Разделение фаз в гравитационном поле
Гравитационные силы — силы притяжения Земли, силы тяжести — очень широко используются для отделения от жидкости твердых частиц. Так отделяют от жидкости как взвешенные в воде загрязнения, так и образовавшиеся при кристаллизации по уравнениям (1–4) малорастворимые вещества. Закон Стокса [5] позволяет вычислить скорость V оседания одиночной частицы в зависимости от ее размера и других условий, при которых ведется осаждение:
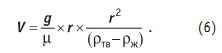
В уравнении (6) g — гравитационная постоянная; m — вязкость жидкости, в которой происходит отстаивание; r — размер твердой частицы; rтв, rж — плотность (удельный вес) твердой частицы и жидкости, соответственно. Изменение границы осадка hoc во времени [6] (консолидированный отстой) описывает следующее уравнение:
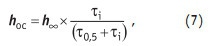
где: h• — высота границы осадка при «бесконечном» времени отстаивания t; t0,5 — отрезок времени, за который данная суспензия осядет на 0,5 к первоначальному уровню высоты. Дифференцируя уравнение (7) определим скорость осаждения:
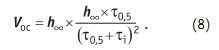
На поверхности осадка за счет адсорбции ионов из раствора образуется двойной электрический слой. Именно знак и величина заряда потенциалообразующего слоя определяет степень уплотняемости Y осадка:
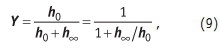
где: h0 — высота слоя суспензии до начала процесса осаждения. Уравнения (6–9) лежат в основе расчета осветлителей и отстойников.
Коагуляция, флокуляция
Явление коагуляции очень напоминает кристаллизацию, но, в отличии от последней, когда видимый глазом кристалл образуется за счет объединения отдельных растворенных молекул, при коагуляции агрегируют (слипаются) под влиянием сил межмолекулярного взаимодействия мелкие невидимые глазом твердые частицы. Если рентгеноструктурный анализ выявляет в кристалле определенную характерную для данного вещества структуру, то слипшиеся коллоидные частицы — флокулы — кристаллической структурой не обладают. Показано, что первой стадией процесса кристаллизации является коагуляция «критических» зародышей с последующим образованием кристаллической структуры. Под флокуляцией понимают образование хлопьев, флокул вне зависимости от того, по какому механизму и с включением каких молекул или частиц какого размера они образовались.
Адсорбция и ионный обмен
Адсорбцией называют сгущение газообразного или растворенного вещества на поверхности раздела фаз. Материал, на поверхности которого произошла адсорбция, называют адсорбентом. Различают физическую (ван-дер-ваальсовскую) и химическую адсорбцию (хемосорбцию). Физическая адсорбция происходит за счет сил межмолекулярного взаимодействия и обратима. Рост температуры увеличивает кинетическую энергию адсорбировавшихся молекул, за счет чего возрастает вероятность их отрыва от поверхности. Типичными адсорбентами, на поверхности которых идет физическая адсорбция, являются активированный уголь и силикагель. Нагревая отработавший адсорбент и удаляя адсорбировавшееся на поверхности вещество, можно полностью восстановить его адсорбирующую способность. Способность к адсорбции выражается размером адсорбирующей поверхности (м2) одного грамма адсорбента. Химическая адсорбция происходит из-за химического взаимодействия адсорбента и адсорбата. В отличии от физической, она усиливается с ростом температуры. Как следует из химической кинетики, повышение температуры увеличивает скорость химических реакций. Ионитами или ионообменными материалами называют нерастворимые вещества, способные обменивать содержащиеся в них ионы на другие ионы того же знака, находящиеся в омывающем ионит растворе. История ионообменных материалов начиналась с неорганических соединений, но с годами их вытеснили синтетические ионообменные смолы. Научились синтезировать смолы с чрезвычайно широким спектром свойств. Катиониты обменивают катионы, положительно заряженные ионы. Аниониты обменивают отрицательно заряженные ионы. Ионообменные смолы обладают высокой механической прочностью, химической стойкостью и большой обменной емкостью. Они удобны в эксплуатации. Обмен ионов происходит во всем объеме смолы, так как растворенные в воде ионы свободно проникают сквозь структурную решетку смолы. Не представляет труда изготавливать гранулы ионообменной смолы любого размера, но с ростом размера гранулы падает поверхность ее контакта с очищаемой водой, замедляется скорость обмена–регенерации. С другой стороны, с уменьшением размера гранул увеличивается гидравлическое сопротивление слоя ионита, фильтрующая способность. В случае ионного обмена приходится иметь дело, пожалуй, с химической адсорбцией. Интенсивность ионного обмена с ростом температуры возрастает, но увеличение температуры ограничено свойствами полимерного материала — при высокой температуре он может размягчаться, плавиться. В случае с ионообменной смолой работает первый закон химической кинетики: скорость химической реакции определяется концентрацией ее участников. Например, мы используем катионит, насыщенный ионом натрия, для удаления из воды ионов солей жесткости (кальция и магния). Постепенно в процессе обмена концентрация натрия в катионите уменьшается за счет замены его на кальций и магний, хотя концентрация кальция-магния в поступающей на очистку воде остается прежней. По мере того, как «срабатывается» ион натрия, падает до нуля скорость обмена его на кальций-магний. Тогда ионообменную смолу регенерируют, промывая концентрированным раствором хлорида натрия. Теперь натрий вытесняет кальций-магний из смолы, занимая их место. И так до тех пор, пока концентрация натрия в смоле не станет максимально высокой. Ионообменные смолы получают либо конденсацией, либо полимеризацией мономеров, содержащих активные группы. Возможен ввод активных групп в уже готовые полимеры. С ростом их концентрации растет обменная емкость смолы, но одновременно растет способность набухать и растворяться в воде. Обменная емкость ионитов выражается числом грамм-эквивалентов извлекаемого из воды иона на 1 г сухого ионита.
Фильтрация
Движение жидкости или газа сквозь пористую перегородку называют фильтрацией. Это определение не ограничивает размер пор и может быть применено как к фильтровальным перегородкам с размером пор порядка миллиметров, так и к мембранам с размером пор порядка нанометра, то есть порядка размера молекул. Приведем уравнение, определяющее скорость фильтрации [7], то есть объем фильтрата, проходящий через пористую перегородку в единицу времени:
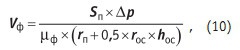
где: Sп — площадь поверхности фильтрующей перегородки; Dp — разность давлений по обе стороны фильтрующей перегородки; mф — вязкость фильтрата; rп — удельное сопротивление фильтрованию фильтрующей перегородки; rос — удельное сопротивление фильтрованию слоя осадка; hос — толщина слоя осадка на фильтрующей перегородке. Из уравнения (10) следует, что скорость фильтрации определяется давлением и пористостью фильтрующей перегородки, обуславливающей ее удельное сопротивление фильтрованию. Чем выше rп, тем выше надо поднимать давление. По мере того, как взвешенные частицы при фильтровании будут отделяться от жидкости и образовывать на поверхности фильтрующей перегородки слой осадка hос, скорость фильтрации будет падать. Если осадок будет попадать в поры и перекрывать их, постепенно будет возрастать и rп, что тоже приведет к снижению скорости фильтрования.
Осмотические явления
Осмосом называется самопроизвольный переход вещества через полупроницаемую мембрану, разделяющую два раствора с различной концентрацией или раствор и чистый растворитель. В общем случае растворенное вещество из раствора с высокой концентрацией пытается перейти в раствор с низкой концентрацией. Если повысить давление в растворе с низкой концентрацией, то поток растворенного вещества прекратится. Разность давлений, прекращающая переток вещества (фильтрацию) через мембрану, называется осмотическим. Осмотические явления чрезвычайно распространены в растительном и животном мире. Осмос обеспечивает проникновение питательных веществ в клетку и вывод в межклеточную среду продуктов жизнедеятельности. Благодаря осмотическому давлению живая клетка имеет форму. Если живую клетку поместить в концентрированный раствор соли, она погибнет от избытка проникшей в нее соли. Обратным осмосом называют метод разделения растворов. Если раствор (очищаемую воду) подать под давлением 3–8 МПа на полупроницаемую мембрану, то вода профильтруется через поры, а растворенное вещество останется. Эффективность обратного осмоса оценивают по селективности мембраны — способности удерживать ионы и молекулы разного размера, а также по удельной производительности единицы поверхности. Сегодня синтезированы полимерные мембраны с широким диапазоном размеров пор и с высокой механической прочностью. Как следствие, комплектуя мембранный аппарат набором мембран с уменьшающимся по ходу движения жидкости размером пор, можно получить из раствора органических и неорганических соединений особо чистую воду. Среди мембранных методов разделения различают: обратный осмос, ультрафильтрацию, диализ, электродиализ. Как правило, мембранные процессы протекают при температуре окружающей среды без фазовых превращений. Этим обусловлена простота и экономичность мембранных установок.
Озонирование
Озон, химическая формула О3, — модификация кислорода. Газ синего цвета с резким запахом. Растворимость в воде при 20°С — 0,039% объемных. Очень легко разлагается по схеме О3 Ѓ О2 + О, образуя атомарный кислород — сильнейший окислитель. Собственно благодаря этой своей способности озон применяется для очистки воды как эффективное бактерицидное средство.
Ультрафиолетовое излучение
В русскоязычной литературе параллельно используются термины УФ-излучение и ультрафиолетовые лучи. УФ-излучение занимает спектральную область между видимым и рентгеновским излучением в пределах длин волн от 400 до 10 нм. Весь диапазон УФ-излучения условно разделяют на ближнюю область (400–200 нм) и далекую или вакуумную (200–10 нм). При взаимодействии УФ-излучения с веществом может происходить ионизация атомов, то есть образование ионов и свободных электронов, а также фотоэффект, то есть испускание электронов. Применение УФ-излучения при очистке воды основано на ионизации молекул, образовании свободных радикалов и происходящих при этом химических изменениях, приводящих к гибели микроорганизмов.
3. ВОДОПОДГОТОВКА
К воде, применяемой в промышленности, предъявляются существенно более низкие требования, чем к питьевой. Соответственно, более низкие требования предъявляются к составу воды в источниках промышленного водоснабжения. Как следствие, набор используемых технических средств и способов подготовки воды несколько ниже. Я не говорю сейчас о подготовке воды для фармацевтической промышленности, к которой предъявляются более жесткие требования, чем даже к питьевой воде. Как уже указывалось в разделе 1, огромные количества воды использует энергетика: малая — отопление, горячее водоснабжение, кондиционирование — и большая — производство электрической энергии.
Водоподготовка на ТЭС и АЭС
По принятым в СССР, а теперь в России и странах СНГ нормам, питательная вода котлов высокого давления должна содержать растворенных веществ не более 10 мкг/л. Такая норма вынуждает применять сложную, многостадийную схему очистки воды. Вначале подогретая сырая, то есть неочищенная, вода поступает на стадию предварительного (химического) умягчения. На этой стадии предстоит максимально снизить концентрацию в ней солей жесткости, железа, углекислоты, кремниевой кислоты, примесей органических веществ, твердых взвешенных частиц. Все эти задачи решаются добавлением к сырой воде осадительных реагентов, коагулянта или флокулянта. Малорастворимые соединения, образовавшиеся по реакции (1–4), выпадают в осадок, сворачиваются в флокулы и отделяются от предварительно умягченной воды осаждением в гравитационном поле. Процесс осветления происходит в отстойниках-осветлителях, диаметр которых может достигать 60 м. Осветленная вода проходит песочные фильтры и далее поступает на целый ряд ионообменных фильтров: катионитовых и анионитовых. Только после этого удается достичь установленной нормы: общего содержания примесей не более 10 мкг/л. Чем меньше примесей останется в предварительно умягченной воде, тем ниже нагрузка на ионообменные фильтры. Тем реже их надо выводить на регенерацию, реже промывать после регенерации предварительно умягченной водой. Тем меньше расход реагентов и объемы хлорсодержащих стоков. Сложность задачи, решаемой на стадии химического или предварительного умягчения, заключается в том, что в ограниченном объеме одновременно протекает несколько химических реакций и процессов: зарождение и рост твердой фазы по уравнениям (1–4); адсорбция на ней ионов с образованием двойного электрического слоя; адсорбция на образующейся поверхности раздела фаз растворенных молекул, воды; коагуляция твердой фазы. Естественно, что все процессы, запускаясь независимо, взаимосвязаны через концентрацию отдельных компонентов, через балансы прихода-расхода, через тепломассообмен. В результате суммарную концентрацию кальция и магния в предварительно умягченной воде удается получить 1,1–1,7 мг÷экв/л, что существенно выше равновесной растворимости. Естественным решением задачи повышения эффективности очистки воды от солей жесткости является разбиение процесса на несколько стадий. Уже при двух стадиях процесса очистки удается достичь суммарного содержания ионов кальция и магния 0,6 мг÷экв/л; при 5 стадиях — 0,16 мг÷экв/л. Естественно, что при этом многократно снижается нагрузка на этап ионообменной очистки, сокращается количество регенераций ионообменников, снижаются расход реагентов, объемы сбрасываемых засоленных стоков. Нельзя забывать при решении столь сложной задачи и об интенсивности перемешивания очищаемой воды и реагентов. Достаточно упомянуть, что интенсивное перемешивание раствора при добавлении в него коагулянтов приводит к разбиванию образующихся флокул, делая практически бесполезным использование дорогостоящих флокулянтов. Изменение технологии предварительного умягчения определяет и аппаратурное оформление процесса. Одностадийная очистка предусматривала смешение всех реагентов в нижней конусной части осветлителя. Вызываемые производственной необходимостью в процессе эксплуатации изменения нагрузки на осветлитель приводили к изменению локализации зоны реакции. Перенос реакций очистки и сопутствующих процессов в каскад реакторов стабилизирует работу осветлителя. Скорости отстоя твердой фазы Vтв как индивидуальное свойство конкретной суспензии определяют в лабораторных условиях по уравнению (8). Одновременно по уравнению (9) определяют способность этой суспензии уплотняться. Диаметр осветлителя для работы на стадии предварительного умягчения, так же как и диаметр любого отстойника в химической технологии, выбирают из соотношения скорости отстоя твердой фазы Vтв данной суспензии и скорости восходящего потока Vж жидкости:
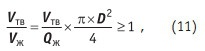
где: Qж — часовой расход жидкости (нагрузка на осветлитель); D — диаметр осветлителя. Однако при конструкции аппарата, когда суспензию на отстаивание вводят в одну точку нижней части осветлителя, очень трудно говорить о равномерном распределении восходящего потока жидкости по всему сечению отстойника, тем более если его диаметр 60 м. Поэтому еще 30 лет назад французская фирма Degremont и акционерное общество из Финляндии «ЭНСО-Гутцейт» начали поставлять на рынок промышленного оборудования отстойники, в которых суспензия подавалась во встроенную внутреннюю камеру большого диаметра через сопло струйного насоса. В результате во внутренней камере (камере созревания флокул) организовывалось многократное медленное перемешивание суспензии в восходяще/нисходящих потоках. Выросшие флокулы оседали на дно отстойника, запирая выход из внутренней камеры гидравлическим затвором. Мелкие флокулы продолжали циркулировать внутри камеры. Вода, выходя из камеры созревания флокул, профильтровывалась через гидравлический затвор из крупных флокул в донной части осветлителя и поднималась к верхнему переливу, равномерно распределяясь по всему сечению осветлителя. Конструкция осветлителя с подобной организацией потоков позволяет поднять качество осветления и исключить из технологической схемы песчанные фильтры.
Водоподготовка для котлов малого давления
Малая энергетика, обслуживающая коммунальное хозяйство и промышленные предприятия пищевой промышленности, применяет котлы низкого давления и малой производительности. В этом случае к очистке питательной воды предъявляются невысокие требования. Достаточно снизить концентрацию солей жесткости в воде, поступающей в водогрейный котел, до 1,5 мг÷экв/л, а в питательной воде паровых котлов в зависимости от давления до 0,1–0,5 мг÷экв/л. Водоподготовка в этом случае может быть обеспечена за счет использования ионообменных материалов: сульфоугля или катионитовых ионообменных смол. Естественно, что технологическая схема водоподготовки должна предусматривать узел приготовления раствора хлорида натрия для регенерации ионообменного материала, промывку ионита водой после регенерации, сброс засоленных стоков.
4. БЕЗРЕАГЕНТНАЯ ВОДОПОДГОТОВКА
В 1936 году бельгийский инженер T.И.C. Вермейрен обнаружил, что при нагревании воды, пересекшей силовые линии магнитного поля, на теплообменной поверхности не образуется накипь (отложение, инкрустация). Первый в мире патент на аппарат магнитной обработки воды [8] был выдан T.И.C. Вермейрену 01.10.1946 г. АО «EPURO» (г. Антверпен, Бельгия) к 1980 г. продало около 130000 таких устройств. В настоящее время приемником этой фирмы является Cepi-CO Ltd. Аппараты системы CEPI с успехом использовались в котельных, в пивоварении, в производстве сахара, в опреснителях морской воды на морском транспорте и так далее. В 80-е годы фирма «EPURO» для обработки воды выпускала аппараты производительностью от 0,03 до 32 тыс. м3/ч и продавала до 5000 шт. в год во все страны мира. В наши дни магнитную обработку жидкостей, в частности воды, благодаря универсальности ее применения считают технологией XXI века и развивают фирмы Magnetizer (г. Нью-Йорк, США, www.magnetizer.com), Magnetic Techno-logies (г. Дубаи, ОАЭ, www.magneticeast. com), Научно-производственные фирмы «Экоэнергия» и «Орион» (г. Харьков, Украина, www.orion.com.ua), Завод коммунального оборудования «Молот» (г. Севастополь, http://www.pump.com. ua), фирма ESW-Kalkwassermagnet (г. Лип-пштадт-Риксбек, Германия, www.ESW-Kalkwassermganet.com) и другие. Механизм предотвращения накипеобразования на теплообменных поверхностях с помощью «магнитной обработки» — магнитогидродинамического (МГД) резонанса — подробно описан в ранее опубликованной статье [4]. Он сводится к инициированию в воде структурной перестройки — фазового перехода второго рода (ФП2). В результате карбонат кальция, который обычно при наличии пересыщения кристаллизуется в кристаллографической модификации кальцита, начинает кристаллизоваться в модификации арагонита. У арагонита существенно отличающиеся свойства: высокое кристаллографическое несоответствие к окислам и карбонатам железа, которые при некачественной деаэрации образуются на стальной поверхности; низкая адгезия к стали; низкая когезия отдельных кристаллов друг к другу; низкая устойчивость пересыщенного раствора. Устройство для инициирования в жидкости ФП2 называется магнитогидродинамический (МГД) резонатор. Если в первых аппаратах магнитной обработки воды Вермейрен использовал для создания магнитного поля электромагнит, то уже в 60-х годах ХХ века он, а вслед за ним и все остальные стали применять постоянные магниты. МГД-резонатор выглядит чрезвычайно просто и очень удобен в эксплуатации. Его внешний вид можно найти на сайтах фирм-изготовителей, перечисленных выше. Мы приведем для иллюстрации фотографию МГД-резонаторов харьковских фирм НПФ «Экоэнергия» и «Орион» (рис. 1 и 2). МГД-резонатор монтируется в трубопровод жидкости, так как для его эффективной работы необходимо обеспечить два условия: определенную скорость пересечения жидкостью магнитных силовых линий и определенное для данной жидкости и данного технологического процесса значение магнитной индукции. МГД-резонатор на постоянных магнитах не требует затрат электроэнергии, не требует эксплуатационных затрат. Согласно ГОСТ на постоянные магниты, они теряют 1% своей намагниченности за 15 лет. Поскольку настройку на нужное значение магнитной индукции надо произвести с точностью 1%, могло бы показаться, что очередную подстройку на объекте эксплуатации надо будет повторить через 15 лет после пуска в эксплуатацию МГД-резонатора. Однако не все так просто. Перечислим проблемы, возникающие при эксплуатации МГД-резонаторов. o Постоянные магниты довольно значительно меняют собственную магнитную индукцию с изменением температуры. Коэффициент температурной зависимости отрицательный. Это означает, что с ростом температуры собственная магнитная индукция постоянных магнитов снижается. Естественно, что для разных магнитных материалов температурный коэффициент разный. Есть магнитные материалы, у которых этот коэффициент равен нулю. Но такие постоянные магниты надо намагничивать непосредственно в магнитной системе в сборе, что создает определенные проблемы. Естественно, что МГД-резонаторы, использующие не реагирующие на изменение температуры постоянные магниты, невозможно подстроить непосредственно на объекте.
- Большой проблемой является создание в магнитном зазоре, через который протекает жидкость, однородного магнитного поля.
- В магнитном зазоре могут скапливаться ферромагнитные частицы, содержащиеся в воде. Они могут изменить проходное сечение МГД-резонатора, а значит и скорость пересечения жидкостью магнитных силовых линий. Они могут шунтировать магнитное поле, нарушая настройку на необходимое для данного технологического процесса значение магнитной индукции.
В технической литературе за последние 60 лет накопилось большое число противоречивых мнений об эффективности применения МГД-резонаторов. Причем совершенно обоснованных. Все эти высказывания можно разбить на четыре группы:
- Применение МГД-резонаторов (аппаратов магнитной обработки, магнетайзеров и так далее) чрезвычайно эффективно и экономически оправдано.
- МГД-резонаторы (аппараты магнитной обработки, магнетайзеры и так далее) в первый период эксплуатации работают хорошо, но со временем эффект исчезает.
- Эффект применения МГД-резонаторов (аппаратов магнитной обработки, магнетайзеров и т.д.) невоспроизводим. Результат их применения то наблюдается, то исчезает.
- МГД-резонаторы совершенно бесполезная вещь.
Надеюсь, что возникающие при эксплуатации МГД-резонаторов проблемы, перечисленные выше, вполне объясняют причину появления столь противоречивых мнений. Самым главным и тонким моментом в обеспечении эффективной работы МГД-резонаторов является точная настройка на резонансную частоту. МГД-резонатор при правильной настройке в состоянии изменять энтропию жидкости и, как следствие, все ее свойства. Именно поэтому его можно назвать универсальным и незаменимым устройством для интенсификации любых технологических процессов. Приведу примеры успешного применения МГД-резонатора в пределах процессов и технологий, ограниченных тематикой этой статьи. Хочу сразу подчеркнуть, МГД-резонатор не может заменить ни один технологический процесс: он не может умягчить воду, не может ее нагреть или испарить, не может заменить ни фильтр, ни отстойник. Он может изменить энтропию (структуру) воды и тем самым заставить привычные технологические процессы протекать несколько иначе. Другими словами, МГД-резонатор — вспомогательное средство, приводящее к снижению энергозатрат, затрат сырья или реагентов, уменьшению объема выбросов жидких и газообразных отходов. В разделе 2 этой статьи коротко описан процесс водоподготовки воды на электростанциях.
- При подогреве воды в ПСВ (подогревателе сырой воды) перед химводоочисткой до технологических норм на трубках пароводяного подогревателя откладывается накипь. МГД-резонатор, смонтированный перед ПСВ, позволяет провести подогрев воды в безнакипном режиме, снизить энергозатраты на подогрев, снизить эксплуатационные затраты на обслуживание ПСВ. Поскольку вода около 24 часов «помнит» воздействие магнитного поля, что на языке науки звучит так: «Время релаксации воды около 24 ч», — положительное влияние изменения свойств воды проявится и на стадии предварительного умягчения.
- Скорость кристаллизации арагонита выше, чем у кальцита. Арагонит не так долго способен находиться в пересыщенном состоянии. Именно поэтому в каскаде реакторов, в котором предусмотрено проведение реакций кристаллизации малорастворимых веществ согласно уравнениям (1–4), не будет откладываться карбонат кальция. Без применения МГД-резонатора отложения карбоната кальция сделают просто невозможной эксплуатацию описанной в разделе 3 технологии и достижение с ее помощью описанных результатов.
- Наблюдения показали, что использование МГД-резонатора для обработки воды перед стадией химической очистки с применением коагулянта позволяет в 5–6 раз повысить качество очистки от органических примесей.
- Во всей научно-технической литературе описано, что скорость оседания твердых частиц растет с повышением температуры. Это прекрасно согласуется с уравнением Стокса (6): рост температуры снижает вязкость воды, в которой ведется отстой. МГД-резонатор меняет известные «законы природы» на обратные. Если очищаемый раствор подвергнуть «магнитной обработке», то скорость отстоя взвешенных будет расти по мере снижения температуры [9]. Технологический регламент химочистки воды на ТЭС предусматривает подогрев воды в ПСВ до 30–32°С. Практика показала, что снижение температуры воды до 22°С повышает скорость отстоя в 1,3 раза. С точки зрения энергосбережения снижение на 10°С температуры подогрева 100 м3/ч очищаемой воды приводит к экономии 1000 Мкал пара в час.
- МГД-резонанс настолько изменяет свойства воды, что адсорбционные и ионообменные процессы в ней протекают гораздо быстрее. Поскольку очистка воды на ионитах ведется в непрерывном режиме, но любой процесс характеризуется определенной скоростью, время контакта воды и ионита в так называемом ионообменном фильтре ограничено. Как следствие, обменная емкость ионитов не используется полностью. Увеличив скорость обмена удается увеличить и динамическую обменную емкость. Поскольку в процессе регенерации смолы работают те же самые механизмы обмена, что и в основном процессе ионообменной очистки, необходимо обрабатывать в МГД-резонаторе и растворы, применяемые для регенерации ионитов. Опыт эксплуатации МГД-резонаторов в процессе подготовки воды в котельных показал, что удается увеличить динамическую обменную емкость сульфоугля в 2–3 раза, но только в 1,2–1,3 раза у катионитов типа КУ-2.
- МГД-резонатор можно настроить на режим снижения вязкости воды. В этом случае скорость фильтрования, как следует из уравнения (10), возрастает. Обычно увеличение скорости фильтрования достигает 10–15%.
- Неоднократно показано, что «омагниченная» вода увеличивает проницаемость биологических мембран, ускоряя доставку питательных веществ внутрь биологической клетки. Естественно ожидать повышения скорости фильтрования воды через мембраны и в процессах водоподготовки, использующих осмос или обратный осмос.
- В зависимости от резонансной частоты можно увеличить или уменьшить растворимость кислорода и углекислоты в воде. Работа в режиме снижения концентрации углекислоты в воде приведет к уменьшению расхода реагентов на очистку от нее. Работа в режиме повышения растворимости кислорода увеличит скорость коррозии трубопровода и оборудования, но повысит эффективность озонирования.
- Чрезвычайно полезным оказывается применение МГД-резонаторов в малой энергетике для водоподготовки питательной воды водогрейных и паровых котлов. Если для водоподготовки используется ионный обмен, то МГД-резонанс позволяет увеличить динамическую обменную емкость ионитов, «подстраховать» котлы с точки зрения предотвращения накипеобразования. Однако самым главным в тепловых процессах является способность МГД-резонанса изменять теплоемкость и удельную теплоту парообразования воды.
Вспомним уравнения термодинамики. Теплоемкость — функция изменения энтропии Sж с изменением температуры Т:
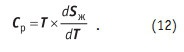
Удельная теплота испарения (парообразования) — это разность энтропий пара и жидкости при температуре процесса:
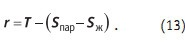
МГД-резонанс меняет энтропию жидкости (структуру). Именно поэтому меняется теплоемкость и теплота испарения. Причем температура, при которой протекает процесс, выполняет роль «линейного усилителя» — чем выше температура, тем выше «эффект изменения» теплофизических характеристик воды под влиянием «омагничивания». Проблема, однако, в том, что в полном соответствии с диаграммой состояния воды, рост теплоемкости сопровождается снижением удельной теплоты парообразования, и наоборот. Поэтому, когда мы с помощью МГД резонанса снижаем одну характеристику, автоматически увеличивается другая. И тут полезно знать и выбирать. Поскольку теплоемкость воды в диапазоне температур от 0 до 150°С — 4,2–4,3 кДж/(кг•К), а удельная теплота парообразования 2114–2500 кДж/кг, при использовании МГД-резонатора для подготовки питательной воды парового котла имеет смысл устанавливать резонансную частоту, приводящую к снижению теплоты парообразования. Если выиграешь при этом на испарении 1 кг воды 10%, но проиграешь 10% энергоемкости нагрева до температуры кипения, суммарный выигрыш составит:
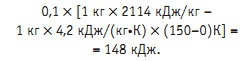
Естественно, что при работе с водогрейным котлом есть смысл устанавливать частоту, приводящую к снижению теплоемкости. Отметим, что «безнакипный режим» достигается всегда, т.к. структура воды изменяется в каждом из этих случаев. Накопленный опыт показывает, что при работе с водогрейными котлами МГД-резонатор позволяет сэкономить 10–15% топлива. Экономия естественно выше при высоких температурах, то есть когда мороз на улице сильнее, а значит и температуру воды на выходе из котла в соответствии с графиком следует держать выше. При работе с паровыми котлами экономия топлива на производство 1 т пара достигает 20–30%.
5. ОЧИСТКА ВОДЫ
Из вышеизложенного становится ясным, что в принципе приемы, направленные на очистку воды, не отличаются от технических приемов водоподготовки. Поэтому в этом разделе мы коротко их охарактеризуем, главное внимание обращая на опыт эксплуатации. В качестве основы для подготовки этого раздела приняты принципы, которые стали нормой при очистке воды в США и странах Европы. Вода подземных источников, поступающая в систему водоочистки, должна соответствовать стандартам на питьевую воду. Несмотря на то, что природная вода должна быть пригодна для питья, в ней могут присутствовать достаточно проблематичные загрязнители как результат деятельности человека и его отрицательного влияния на окружающую среду. В частности, к таким проблемам относится, несомненно, хлор и его соединения, которые должны быть удалены на какой-либо стадии процесса очистки. Снижение содержания примесей в воде часто достигается теми же процессами, которые применяются для снижения концентрации ионов. Однако, если обычно мембранная технология для снижения концентрации ионов используется ограниченно, в некоторых случаях ее все же приходится применять для снижения общего содержания загрязнений. В частности, мембранные технологии приходится применять для подготовки воды в целях хранения. Поддержание низкого содержания бактерий в процессе водоподготовки, хранения и распределения воды весьма трудная задача, поэтому бактериальный контроль ведется на всем протяжении движения воды от источника водоснабжения и до потребителя. Перечислим некоторые этапы водоподготовки, гарантирующие ее качество: удаление взвешенных, удаление хлора, снижение концентрации ионов, бактериологический контроль и удаление специфичных загрязнителей.
Удаление хлора
В данном случае под хлором мы будем понимать не только элементарный хлор — газ зеленоватого цвета, а любые хлорсодержащие соединения. Существует несколько методов удаления хлора из воды. Наиболее распространенным является фильтрация через активированный уголь. Но есть и другие удаляющие хлор составы, например, включающие разнородные металлы. Хлор может быть удален восстановителем метабисульфитом натрия. Недавно было показано, что высокая дозировка ультрафиолетового излучения также снижает концентрацию хлорсодержащих веществ.
Фильтрация через уголь
Уголь способен удалять как растворенный в воде свободный хлор, так и хлор-амины. Но в последнем случае время контакта воды и угля надо существенно увеличивать. Слой угля для удаления свободного хлора должен занимать в зависимости от концентрации хлора и исходных характеристик воды от 2 до 5 слоев, заполняющих объем аппарата. Для удаления хлораминов количество слоев должно составлять 7,5–12. Угольные фильтры также эффективны для снижения общего содержания примесей. Наибольшей проблемой угольных фильтров является их предрасположенность к заселению колониями бактерий. Для борьбы с этим угольное заполнение надо периодически подвергать санитарной обработке горячей водой или паром. Кроме того, для дезинфекции воды источник УФ-излучения должен быть установлен как на входе, так и на выходе из угольного фильтра. Это увеличит продолжительность интервала между санитарными обработками. Качество угля, используемого для заполнения угольных фильтров, также играет определенную роль. Если уголь используется для удаления специфичных органических соединений, он должен обладать соответствующими характеристиками. Желательно минимальное содержание примесей в угле, низкая зольность и достаточно высокая механическая прочность. Весь уголь сразу после загрузки следует промыть кислотой непосредственно в технологических емкостях. После пуска угольный слой следует промывать, пока из него не будут удалены мелкие частицы. Угольный слой должен периодически взрыхляться обратным потоком воды в течение всего срока эксплуатации. Другими гранулированными материалами, эффективными для удаления хлора, являются композиции из разнородных металлов. Они не подвержены заселению бактериями, что является их существенным преимуществом. Однако высокая стоимость композиций из разнородных металлов ограничивает их применение для удаления хлораминов, а высокий вес существенно увеличивает расход воды на взрыхление.
Применение реагентов
Ввод реагента непосредственно в поток воды требует очень мало оборудования: дозировочных насосов и статических реакторов. Следовательно капитальные затраты на такой метод удаления соединений хлора крайне невысоки. Основные затраты определяются стоимостью реагентов. Осложнением, возникающим при использовании реагентов для удаления хлорсодержащих соединений, является стимулирование роста некоторых организмов, разрастающихся на оборудовании, в котором производится осаждение. По этой причине дозировка реагентов должна поддерживаться на таком низком уровне, который бы не приводил к быстрому росту этих организмов. Именно это требование и является трудновыполнимым: сложно поддерживать минимальную дозировку реагентов в условиях изменения концентрации хлорсодержащих соединений в широком диапазоне.
УФ-излучение
Ультрафиолетовое излучение широко используется в системах очистки воды для дезинфекции и снижения концентрации всех загрязнений. Использование УФ-излучения для удаления хлорсодержащих соединений — относительно новый процесс, но благодаря способности разрушать многие химические соединения этот прием получает все большее распространение, так как дозировки УФ-облучения подобраны и проверены на практике. Показано, что УФ-излучение гораздо более эффективно по сравнению с реагентами для разрушения хлорсодержащих соединений. Разрушение хлораминов требует существенно более высоких дозировок, чем удаление свободного хлора. Поэтому иногда выгодно для этой цели использовать окислители в комбинации с УФ-излучением. Капитальные затраты на применение УФ-излучения в случае удаления свободного хлора сравнимы с таковыми в случае применения угольной фильтрации. Существенный вклад в затраты на применение УФ-излучения для удаления хлора вносит стоимость электроэнергии. Однако эти затраты оправдываются, т.к. устраняя из технологической схемы угольные фильтры, мы устраняем основу для роста колоний бактерий. Кроме того, вода в значительной степени дезинфицируется, что весьма полезно всей системе водоочистки.
Удаление ионов
Существует три основных способа снижения концентрации ионов: мембранные процессы, ионный обмен, дистилляционный процесс. На практике используются много разновидностей и комбинаций этих способов, что открывает почти бесконечные возможности в их использовании при водоочистке.
Мембранные процессы
Мембранные процессы широко применяются в системах водоочистки для удаления: ионов, твердых взвешенных, органических соединений и микроорганизмов. Диапазон размеров пор мембран, выпускаемых промышленностью, весьма широк: от размеров сравнимых с размерами коллоидных частиц до размеров ионов. Ионоудаляющие мембраны занимают «тесный» участок спектра размеров пор и включают мембраны обратного осмоса (ОО) и нанофильтрующие мембраны. В настоящее время химия мембран настолько доведена до совершенства, что степень разделения ионов различного размера находится где-то между 99,9 и 50%, стирая различие между понятиями нанофильтрации и фильтрации при низком давлении. Теперь есть смысл обсуждать не размеры пор мембран, а особенности эксплуатации мембран из целлюлозы и других полимеров. Целлюлозные мембраны устойчивы в присутствии окислителей бактерицидного происхождения и по существу могут работать в присутствии дезинфицирующих веществ, применяемых для уничтожения микроорганизмов, паразитирующих на материале мембран. Несмотря на то, что к преимуществам целлюлозных мембран можно отнести и возможность содержания в воде незначительных количеств хлора, остающегося в воде при использовании процесса обратного осмоса, преимущества нецеллюлозных мембран существенно превосходят отмеченное положительное свойство целлюлозных мембран. Нецеллюлозные мембраны работают при значительно более низких давлениях и в широком диапазоне значений рН. Недаром во всех наиболее прогрессивных технических решениях используются именно нецеллюлозные мембраны. Одной из наиболее важных характеристик ионоудаляющих мембран является их высокая ионосепарирующая способность вне зависимости от концентрации ионов в потоке (вплоть до максимального осмотического давления). Это еще одно существенное преимущество по сравнению с ионным обменом, при котором каждый удаляемый ион заменяется на какой-либо другой. Именно эта характеристика фактически предопределяет включение мембранного разделения в каждую систему удаления ионов. Очень редко экономически оправдано использование ионного обмена для удаления только одного иона. Основополагающим решением в применении мембранного разделения является возможность использования систем с одноили двукратным изменением направления потока очищаемой воды. Еще одной проблемой при мембранной очистке являются растворенные в воде газы, особенно СО2, но и эти проблемы решаются использованием дегазифицирующих мембран. Применение мембранной технологии предъявляет высокие требования к соблюдению заложенных в проекте норм технологического режима, аналитического контроля и правил промывки. Первым условием надежной работы систем мембранной очистки является постоянный расход воды, выражаемый в литрах на квадратный метр площади мембраны в сутки (ЛМС). Обычно промышленные мембранные системы очистки рассчитываются на расход 0,4–0,6 м3/м2 в сутки. Поток питательной воды направляют в систему мембранной очистки вначале на мембраны с крупными порами, а затем к мембранам с все более понижающимися по размеру порами. Из питательной воды перед подачей в систему мембранной очистки следует удалить загрязнения, которые могут быть причиной засорения или образования отложений на мембранах. Очень важно постоянно в процессе эксплуатации контролировать давление и расход воды через мембранную систему, поскольку именно эти два параметра определяют соблюдение условий постоянства технологического режима и отражают все отклонения от него. Необходимо постоянно отслеживать характеристики как питательной воды, так и очищенной воды на выходе из системы очистки. Качественный контроль состоит из действий, направленных на соблюдение всех отмеченных выше условий работы мембранной системы. Температура — очень важный фактор, определяющий вязкость m воды и, как следствие, скорость ее фильтрации через мембрану (10). Часто питательную воду, поступающую на очистку, в мембранных системах, использующих обратный осмос, нагревают до 25°С, хотя это не всегда экономически оправдано. Более рациональным приемом является использование МГД-резонатора, снижающего вязкость воды и повышающего производительность фильтрации без затрат на подогрев. Промывка мембран отфильтрованной водой перед остановкой установки является неотъемлемой частью устранении загрязнения и предотвращения отложений на мембранах. Это особенно важно в системах, применяющих антинакипин. Совместное применение автоматизированной общей чистки мембран и санитарной обработки системы увеличивает продолжительность ее работы и снижает затраты на обслуживание.
Ионный обмен
Хотя двухходовой обратный осмос (ОО) во многих случаях может обеспечить необходимое удаление ионов, часто проекты систем очистки воды предусматривают стадию ионного обмена, размещаемую вслед за установкой ОО. Ионный обмен удаляет СО2, который в системе ОО может быть причиной сбоев при контроле качества очистки. Кроме того, в некоторых случаях считается приемлемым в очень низкорасходных системах очистки воды применять портативные ионообменные емкости как единственный метод снижения концентрации ионов. Использование ионного обмена вслед за установкой ОО повышает надежность всей системы очистки. Однако при этом возникает несколько проблем. Общеизвестно, что колонии бактерий охотно поселяются на поверхности гранул ионообменного материала, особенно на смесях катионита-анионита, имеющих нейтральный рН. Кроме того, на стадии регенерации ионообменных материалов используются рискованные реагенты и сложное оборудование. Применение ионообменных емкостей создает постоянную «непредсказуемость» в процессе водоподготовки. Некоторые из этих проблем уменьшаются проверенными способами применения ионообменной технологии. Например, раздельное использование катионитов и анионитов обеспечивает сильно отличающиеся от нейтрального значения рН на ионитах разного типа, что подавляет рост бактерий. Одновременно, раздельное применение катионитов и анионитов облегчает их регенерацию и снижает з


























