Прогрессирующее ухудшение экологической обстановки идет такими темпами, что фундаментальная наука не всегда успевает установить причины тех или иных явлений. В частности это касается установления конкретных причин отрицательного воздействия воздуха на организм человека. Между тем одним из немногих способов, которым можно обеспечить надлежащее качество воздуха в помещении, является внедрение систем вентиляции и кондиционирования воздуха, поэтому с течением времени неуклонно растет количество заказчиков, готовых целенаправленно идти на создание таких климатических систем. При работе с информированным заказчиком приходится учитывать то, что он уже знаком со следующими положениями:
- любая климатическая система, являясь системой воздухоподготовки, подготавливает воздух с определенными микроклиматическими параметрами и химическим составом;
- этот воздух после обработки может оказывать как положительное, так и отрицательное влияние на организм человека.
Поэтому такой заказчик, оплачивая как капитальные, так и эксплуатационные затраты, закономерно начинает предъявлять повышенные требования к созданию климатических систем. Его уже не устраивает аргумент, что создаваемая система будет соответствовать существующим нормам (нормы, конечно, есть, а причины отрицательного воздействия воздуха на организм человека все-таки не установлены).
Между тем нормы для него необходимы как критерий, от которого можно оттолкнуться, а для принятия окончательного решения по созданию систем вентиляции и кондиционирования воздуха необходимы гарантии, что воздух в его помещениях будет обеспечен как минимум приемлемого качества. Такие гарантии может дать только проектировщик, т.к. физический смысл действий проектировщика заключается в следующем: он, используя климатическую систему, ограничивает значения микроклиматических параметров воздуха и влияет на его химический состав, тем самым влияет на процессы, происходящие внутри организма человека.
В том случае, если воздух, обработанный в климатической системе, выводит организм человека из состояния нормы, включаются компенсаторные (защитные) функции организма. Схематично процесс создания и эксплуатации климатической системы можно изобразить следующим образом— см. рисунок. Для того чтобы созданная проектировщиком климатическая система не оказалась причиной подавления защитных функций организма человека, можно в общих чертах рассмотреть эти процессы, используя основы физиологии человека и химии.
Важнейшими для жизнедеятельности человека газами [1] являются кислород и углекислый газ, которые участвуют в газообмене человека с окружающим воздухом. Процентное содержание кислорода в атмосферном воздухе составляет 21%, но изменение его процентного содержания в воздухе не так критично для организма человека, как углекислого газа. Если сокращение содержания кислорода в воздухе происходит за счет инертных газов (например, азота), то нормальное дыхание может наблюдаться и при меньших количествах кислорода — вплоть до 12%.
Содержание же углекислого газа в атмосферном воздухе существенно ниже, чем кислорода — всего 0,03–0,04% от объема. Но в замкнутых помещениях уменьшение содержания кислорода сопровождается накоплением углекислого газа и при концентрации СО2 в 1% человек начинает вдыхать значительно больше воздуха. При концентрации СО2 в 3% дыхание даже в состоянии покоя удваивается, а если человек будет находиться в помещении с такой концентрацией СО2 в течение трех и более суток, ему грозит потеря сознания. Почему это происходит?
Этапы процесса поддержания постоянной кислотности во внеклеточной жидкости организма человека
Окружающая среда может существенно влиять на функции организма, и это влияние может быть достаточным, чтобы подавить защитные механизмы организма. Кислотность во внеклеточной жидкости организма человека (концентрация ионов водорода H+) регулируются в узких пределах [2]. Такое точное поддержание кислотности необходимо для нормального функционирования ферментных и биологических систем в организме человека. И даже небольшие изменения кислотности могут оказывать очень сильное воздействие на функции организма. Процесс, в результате которого концентрация ионов водорода внутри организма остается практически постоянной, включает три основных этапа:
- функционирование вне- и внутриклеточных химических буферных систем;
- уровень СО2 в крови регулируется с помощью альвеолярной вентиляции;
- концентрация бикарбонатов (формула) в крови контролируется путем регуляции почечной экскреции ионов водорода H+.
Буферные системы в организме человека
В результате метаболизма углеводов и жиров в сутки образуется 15000 ммоль СО2, и если легкие окажутся не в состоянии выделять СО2, будет наблюдаться прогрессирующее накопление угольной кислоты, при диссоциации которой образуются ионы водорода, а это может привести к резкому изменению кислотности. Для предотвращения резкого изменения концентрации ионов водорода H+ существуют вещества, называемые буферами. Физиологически важные кислоты в организме человека подразделяются на две основные категории:
1. Угольная кислота (Н2СО3), образующаяся за счет взаимодействия воды и двуокиси водорода:
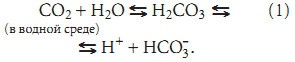
2. Некарбоновые кислоты, образующиеся главным образом вследствие метаболизма белков. Из этих источников образуетсятолько 50–100 мэкв H+ за сутки. Эти ионы водорода нейтрализуются буферными системами и затем выводятся почками.
К самым важным буферам внеклеточной жидкости можно отнести бикарбонат и вторичные фосфаты. Способность легких удалять огромные количества СО2 из крови и способность почек регенерировать бикарбонатный ион позволяет паре бикарбонатный ион – угольная кислота функционировать в качестве основного буфера внеклеточной жидкости.
Кроме системы бикарбонат – СО2 во внеклеточной жидкости есть и другие буферы, в количественном отношении менее важные, буферы, включая неорганические фосфаты (концентрация фосфатов в плазме равна 1,0 ммоль, тогда как содержание бикарбоната — 24 ммоль), гемоглобин и белки плазмы. Общая емкость некарбонатных буферов крови составляет 47% от всех имеющихся буферов. Самая большая доля из этого, 34%, приходится на гемоглобин и оксигемоглобин. Вклад бикарбоната плазмы равен 35%, еще 18% добавляется за счет бикарбоната эритроцитов. Таким образом, 53% общей буферной емкости цельной крови приходится на систему бикарбонат — СО2.
Связь между углекислым газом и концентрацией бикарбоната в плазме
Учитывая, что различные газы растворяются в воде неодинаково, и степень их растворимости пропорциональна парциальному давлению газа в растворе, то растворимость СО2 в плазме можно записать в следующем виде
КраствРСО2 = [СО2]раств , (2)
где Краств — константа растворимости СО2 в плазме; РСО2 — парциальное давление СО2; [СО2]раств — количество СО2, растворенного в плазме. Для гидратации СО2 и диссоциации угольной кислоты (1) закон действующих масс выглядит как:
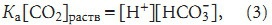
где [H+]— концентрация ионов водорода в плазме; (формула) — концентрация бикарбоната в плазме; Ка — константа диссоциации угольной кислоты. Используя уравнения (2) и (3),получим
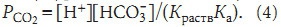
Параметры организма человека в норме:
- Кислотность крови рН = 7,4;
- Содержание бикарбоната в плазме — 24 ммоль/л;
- Парциальное давление СО2 в артериальной крови человека находится в равновесии с парциальным давлением СО2 в альвеолярном воздухе и составляет примерно 40 мм рт. ст. при 37°С.
- Кроме того: Константа диссоциации угольной кислоты Ка или рКа = –lg(Ка)= 6,1.
- Константа растворимости СО2 в плазме Краств = 0,03.
Тогда:
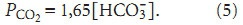
Из уравнения (5) следует, что как увеличение, так и уменьшение парциального давления СО2 в альвеолярном воздухе приводит к тому, что включаются защитные функции организма, изменяя концентрацию бикарбоната в плазме для компенсации этих изменений.
Механизм воздействия воздуха с высоким содержанием углекислого газа на организм человека
Увеличение концентрации углекислого газа в помещении (например, отсутствие вентиляции или при использовании «форточной» системы вентиляции, ошибки проектировщика при расчете воздухообмена в помещении) может привести к увеличению парциального давления СО2 альвеолярного воздуха, а это в свою очередь — к развитию респираторного ацидоза (ацидоз — это процесс повышения концентрации Н+, который приводит к снижению рН крови), который появляется при нарушении выделения легкими СО2.
Защитная функция организма здесь заключается в следующем: для того чтобы не допустить изменения кислотности крови, почки компенсируют это состояние за счет увеличения секреции H+, повышая концентрацию бикарбоната в плазме. Для завершения этой реакции необходимо несколько дней, а для восстановления нормального кислотно-основного баланса требуется коррекция первичного нарушения вентиляции. Отсюда можно сделать выводы:
- Любая климатическая система, вызывающая в организме человека респираторный ацидоз, требует реконструкции.
- Эффективной системой вентиляции по СО2 можно считать такую систему, которая не приводит к увеличению бикарбоната в крови здорового человека.
- Используя инструментальный метод контроля концентрации бикарбоната в плазме здорового человека, можно было бы определить концентрацию СО2 в помещении, т.е. определить, при какой концентрации СО2 в помещении не будут включаться компенсаторные функции организма человека.
- Это значение концентрации СО2 в помещении можно было бы считать научно обоснованной оптимальной нормой по СО2.
- Если человек 80–90% своего времени находится в помещении, то данный процесс можно считать серьезным основанием для целенаправленного внедрения систем вентиляции особенно в помещениях, где используются герметичные стеклопакеты.
Влияние химического состава воздуха на организм человека
Химический состав воздуха также может существенно влиять на функции организма. Из курса химии известно, что слабые кислоты могут являться не только буферами, но, взаимодействуя с ионами металлов, могут образовывать слаборастворимые соединения. Эти процессы также характерны для организма человека (например, образование камней в почках, отложение кальция в межпозвоночных дисках (остеохондроз), образование бляшек (атеросклероз).
Ионы с большими зарядами, такие как фосфат-ион, (формула), и карбонат-ион, (формула), взаимодействуют с катионами сильнее, чем нитраты и перхлораты, с их однозарядными анионами и поэтому фосфаты и карбонаты образуют менее растворимые соли. Если в растворе произведение концентраций ионов металла Ме+ и ионов слабой кислоты А– превысит произведение растворимости ПР:
[Ме+][А–]> ПР, (6)
то в растворе может образоваться твердая фаза МеА(тв). Данная реакция не обязательно должна пройти процесс кристаллизации. Нельзя исключать, что она в организме человека может оказаться промежуточной для других химико-биологических реакций. Тогда наряду с (1) необходимо учитывать еще одну химическую реакцию:
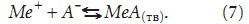
Выражение для константы равновесия этой реакции имеет вид
ПР = Кравн[МеА](тв) = [Ме+][А–], (8)
где ПР — константа равновесия называемая произведением растворимости; [Ме+]— концентрация ионов металла в растворе; [А–]— концентрация ионов кислоты в растворе; [МеА](тв) — концентрация осадка в растворе. В нашем случае А– это могут быть ионы (формула), (формула), (формула), (формула), (формула), ОН–. Ион металла может быть любым, который, взаимодействуя с этими ионами, образует слаборастворимую соль.
Рассмотрим, как теоретически это может происходить в организме человека. У человека концентрация кальция в сыворотке крови поддерживается на постоянном уровне 2,25–2,5 ммоль/л. Около 50% кальция сыворотки крови ионизировано, и 10% находится в виде комплексных соединений, образованных цитратом, фосфатами, бикарбонатами и лактатом. Остальные 40% связаны с белком, главным образом с альбумином. Связь между ионизированным кальцием Са2+ и концентрацией белков в крови может быть представлена следующим образом:

где [протеинат]— соответствует концентрации белка в плазме крови; К— константа равновесия. Наиболее важным фактором, влияющим на связывание кальция с альбумином, является рН плазмы. Ацидоз понижает связывание свободного кальция в крови, в результате чего повышается содержание ионизированного кальция. Следовательно изменение РСО2 может влиять на концентрацию ионизированного кальция в крови. Но кальций, как и некоторые слабые кислоты, находящиеся в плазме, фильтруется в почках. Кроме того, эти кислоты служат в качестве буферов в моче. В основном буферное действие мочи осуществляется за счет (формула):
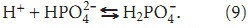
И если учесть реакцию (1) и (7),можно записать:

где [H+]— концентрация ионов водорода; Ка1, Ка2, Ка3 — константы диссоциации фосфорной кислоты.
ПР = Кравн1[Са(Н2РО4)2](тв) = 1•10–3,
ПР = Кравн2[СаНРО4](тв) = 2,7•10–7,
ПР = Кравн3[Са3(РО4)2](тв) = 2,0•10–29.
Из системы уравнений (10) можно предположить, что, при условии
[Са2+][А–]> ПР
в почках может выпадать осадок в виде соединений:
Са(Н2РО4)2,СаНРО4,Са3(РО4)2
или других веществ, а при
[Са2+][А–]< ПР
будет происходить растворение этих соединений. Тем самым, можно предположить, что процесс образования и растворения осадка в почках может являться своего рода буфером по поддержанию постоянной концентрации кальция в крови, т.к. скорость реакции на изменения кальция в крови у данного процесса должно быть существенно выше, чем компенсация за счет костей человека. А патологией тогда можно считать процесс роста камней в почках.
Предположим, что в почки попали ионы свинца Pb, которые могут образовывать с фосфат-ионами такие соединения, как Pb3(PO4)2 с ПР = 7,9•10–43 или Pb5(PO4)3Cl с ПР = 7,5•10–80, тогда выпадение в осадок одного из этих соединений может привести к смещению равновесия и, соответственно, к ацидозу, т.е. влиять на процессы в организме человека возможно могут и тяжелые металлы в особо малых концентрациях.
Следует особо отметить, что:
- образование твердой фазы сопровождается существенным изменением кислотности среды;
- твердая фаза хотя и находится в растворе определенного объема, но на процесс образования этой твердой фазы существенное влияние оказывает высокоразвитая поверхность, в которую заключен данный объем раствора.
На данном примере мы показали только возможность развития данных процессов, а могут ли они протекать в реальных условиях, на этот вопрос может ответить только фундаментальная наука. Но тогда если альвеолярный воздух является поставщиком ионов металла, то аналогичные реакции с образованием слаборастворимых солей, по всей видимости, могут протекать и в легких человека, тем самым, существенно влияя на кислотно-основной баланс организма человека, т.е. рассматривать тогда необходимо будет, по крайней мере, как минимум две реакции:
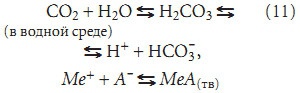
и учитывать диссоциацию всех слабых кислот, присутствующих в крови человека. Кроме того, нельзя исключать, что не только процесс образования слаборастворимых солей в организме человека, но и образовавшаяся соль МеА(тв) тем или иным образом также может влиять на нормальное функционирование организма.
Примечание: Предположения основаны на экспериментальных данных, полученных в лаборатории голографической интерферометрии Сыктывкарского государственного университета при исследовании роста кристаллов в гелях и представлены на международной конференции Crystal Growth в Японии (1988 г.), Китае (1990 г.), США (1992 г.).
Вывод
Можно считать, что если климатическая система, созданная проектировщиком, способна поддерживать в альвеолярном воздухе здорового человека парциальное давление СО2 на уровне около 40 мм рт. ст. при 37°С, то такая система способна обеспечивать качество воздуха в помещении по СО2. Но если окружающий воздух является поставщиком ионов тяжелых металлов на границу раздела альвеолярный воздух— альвеолярная мембрана и в легких человека идет образование твердой фазы, то даже при парциальном давлении СО2 на уровне около 40 мм рт. ст. в крови должна наблюдаться повышенная концентрация бикарбоната.
В том случае если экспериментально будет установлено, что процесс образования твердой фазы в легких все-таки имеет место, тогда, по всей видимости, могут существенно измениться и требования к климатическим системам. Поэтому беспокойство информированного заказчика о гарантиях, что воздух в его помещениях будет обеспечен как минимум приемлемого качества, далеко не беcпочвенно.

























