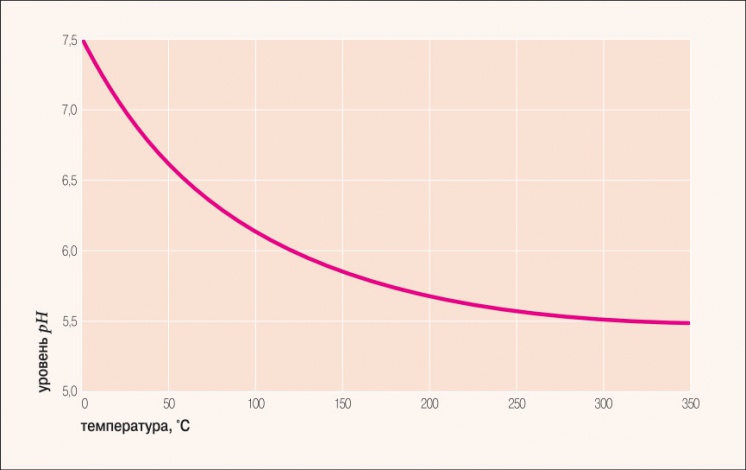
Рис. 1. Водородный показатель дистиллированной воды в зависимости от температуры
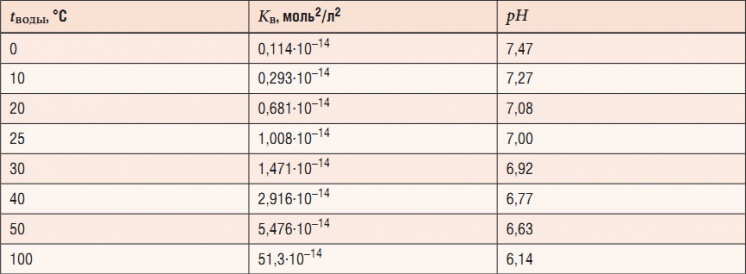
Табл. 1. Значения нейтрального pH в чистой воде при различных температура
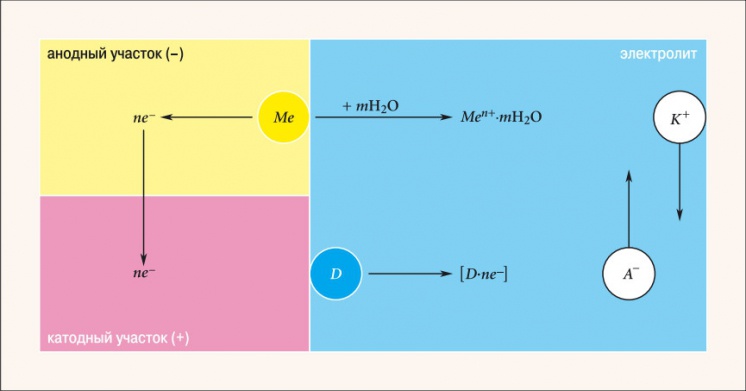
Рис. 2. Схема электрохимического коррозионного процесса

Табл. 2. Значения электродных потенциалов некоторых элементов
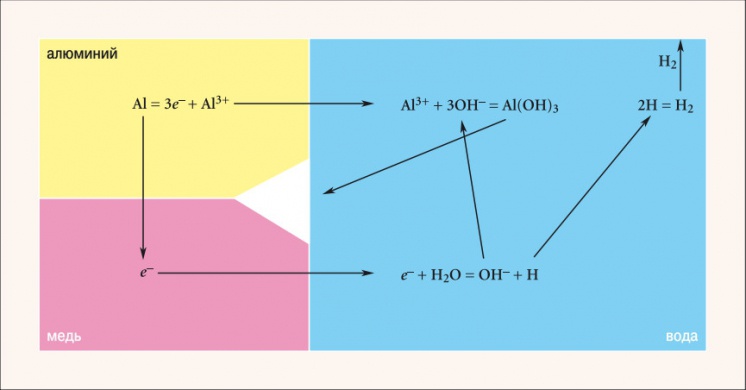
Рис. 3. Схема процесса коррозии при контакте алюминия и меди
Алюминиевые радиаторы очень удобны: они компактны, эстетичны, обладают малой инерционностью и очень высокой теплоотдачей. Теплопроводность изделий из алюминиевых сплавов — 202–236 Вт/(м⋅K). Из металлов, используемых для изготовления радиаторов, выше эта величина только у меди: 382–390 Вт/(м⋅K). У других материалов теплопроводность ниже в разы. При этом алюминий как сырье примерно в два раза дешевле меди.
В то же время с алюминиевыми радиаторами связано множество предрассудков, основанных на незнании потребителем природы химических процессов, происходящих внутри отопительной системы, — существует, например, устойчивое мнение, что с алюминиевыми радиаторами нельзя использовать медные и оцинкованные трубы. Но почему и какому из материалов от этого будет хуже — знают не все. Известно также, что алюминий предъявляет высокие требования к pH теплоносителя. Насколько это серьезно и чем грозит превышение? Попробуем разобраться.
Если не брать в расчет ошибки при расчетах максимального давления, гидроудары и производственный брак, самой распространенной проблемой в алюминиевых радиаторах является т.н. «завоздушивание», в результате которого повышается нагрузка на воздухоотводчик, увеличивается объем подпитки, при неблагоприятном раскладе может лопнуть секция.
На самом деле, выделяющийся газ — это водород H2, продукт взаимодействия алюминия с разнообразными веществами. Происходит данный процесс в трех случаях: реакция алюминия с теплоносителем-водой, реакция алюминия с теплоносителем-гликолем, электрохимическая коррозия алюминия.
Водородный показатель
В первую очередь, возникает вопрос, каким образом алюминий вообще может вступать в реакцию с чем бы то ни было: ведь на воздухе (т.е. сразу после изготовления на заводе) на его поверхности образуется тонкая прочная беспористая оксидная пленка Аl2О3, защищающая металл от дальнейшего окисления и обусловливающая его высокую коррозионную стойкость.
Кроме того, производители дополнительно покрывают внутренние поверхности радиаторов различными составами, препятствующими доступу теплоносителя к алюминию. Поэтому, чтобы «добраться» до металла, надо сперва разрушить оксид.
Самый простой способ — механическое воздействие твердых частиц, которые могут присутствовать в теплоносителе: они вызывают абразивный износ и разрушают защитный слой на внутренней поверхности прибора. Данная проблема легко решается установкой фильтров и грязевиков в нужных местах отопительной системы.
Более интересную ситуацию представляет собой «химическая атака». Она связана с амфотерностью оксида алюминия, т.е. его способностью проявлять как кислотные, так и основные свойства: взаимодействовать как с щелочами, так и с кислотами с образованием солей, хорошо растворимых в воде (это значит, что они не остаются на металле, а поступают в теплоноситель). Пример реакции с кислотой (свойства основного оксида):
Al2O3 + 6HCl ⇒ 2AlCl3 + 3H2O.
Пример реакции с водным раствором щелочи (свойства кислотного оксида):
Al2O3 + 2NaOH + 3H2O ⇒⇒ 2Na[Al(OH)4].
Взаимодействует оксид алюминия, правда, не со всеми соединениями: так, серная или азотная кислоты разрушения пленки не вызовут.
Важнейшим индикатором наличия в воде растворенных кислот является водородный показатель pH (по первым буквам латинских слов potentia hydrogeni — сила водорода или pondus hydrogenii — вес водорода) — концентрация ионов водорода H+ в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов в молях на литр:
pH = –lg[H+].
Вообще, в химии сочетанием pX принято обозначать величину, равную –lgX, а буква H в данном случае обозначает концентрацию ионов водорода H+. Несколько меньшее распространение получила обратная pH величина — показатель основности раствора pOH, равный отрицательному десятичному логарифму концентрации в растворе ионов OH–: pOH = –lg[OH–].
В чистой воде при 25 °C величины концентрации ионов водорода H+ и гидроксидионов OH– одинаковы и составляют 10–7 моль/л. Это напрямую следует из определения ионного произведения воды, гласящего, что произведение концентраций ионов водорода Н+ и ионов гидроксида OH– в воде или в водных растворах при определенной температуре равно константе Kв. Нормальными условиями принято считать 25 °C, при которых Kв = 10–14 моль2/л2. Таким образом, при 25 °C — pH + pOH = 14.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксидионов, соответственно, уменьшается. При добавлении основания, наоборот, повышается содержание гидроксидионов, а концентрация ионов водорода падает. При [H+] > [OH–] раствор называют кислым, при [OH–] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который и назвали водородным показателем pH.
При более высоких температурах константа диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH–); при понижении температуры, напротив, нейтральный pH возрастает. В табл. 1 и на рис. 1 показаны изменения значения нейтрального pH в чистой воде в зависимости от температуры.
При сильных отклонениях значения pH от нейтрального можно с достаточной степенью уверенности говорить о наличии в воде растворенных кислот или оснований, которые могут вступать в реакцию с оксидом алюминия или с защитным покрытием, нанесенным производителем, разрушая их и обнажая алюминий. Из этого следует также, что применять химические реагенты для контроля жесткости теплоносителя в случае с алюминиевыми радиаторами надо с большой осторожностью. В идеале вода должна быть дистиллированной.
Реакция алюминия с теплоносителем
Если оксид алюминия Al2O3 с классическими окислителями в реакцию не вступает, сам алюминий после контакта с водой преобразуется в гидроксид (тоже, к слову, амфотерное соединение) с выделением водорода:
2Al + 6H2O ⇒ 2Al(OH)3 + 3H2.
Если же pH теплоносителя далек он нейтрального, этот же газ будет выделяться в качестве продукта реакции алюминия с щелочами и некоторыми кислотами с образованием растворимых солей:
2Al + 2NaOH + 6H2O ⇒
⇒ 2Na[Al(OH)4] + 3H2,
2Al + 6HCl = 2AlCl3 + 3H2.
Если в качестве теплоносителя используется незамерзающая жидкость, то ситуация будет сходная. При взаимодействии водного раствора этиленгликоля, самого распространенного антифриза, с алюминием происходит замещение гидроксильного водорода на металл и выделение свободного водорода Н2.
Электрохимическая коррозия
Электрохимическая коррозия — наиболее распространенный вид коррозии металлов. При контакте двух металлов, обладающих разными электродными (электрохимическими) потенциалами и находящихся в электролите, образуется гальванический элемент (рис. 2). Поведение металлов зависит от значения их электродного потенциала. Металл Me, имеющий более отрицательный электродный потенциал (анод), переходит в качестве положительно заряженных ионов Men+ в раствор. Избыточные электроны ne– перетекают по внешней цепи в металл, имеющий более высокий электродный потенциал (катод). Катод при этом не разрушается, а электроны из него ассимилируются какими-либо ионами или молекулами раствора (деполяризаторами D), способными к восстановлению на катодных участках. Чем ниже электродный потенциал металла по отношению к стандартному водородному потенциалу, принятому за нулевой уровень, тем легче металл отдает ионы в раствор, тем ниже его коррозионная стойкость. Значения электродного потенциала Е0 некоторых элементов приведены в табл. 2. Расположение металла выше (хотя обычно говорят «левее») водорода означает, что он способен вытеснить водород из соединений (воды, кислот и пр.).
Теперь рассмотрим конкретный пример: пару «медь–алюминий». Сразу отметим, что для возникновения разности потенциалов требуется непосредственный контакт двух металлов (алюминиевый радиатор и медный фитинг), а не просто наличие их в системе (алюминиевый радиатор, медный теплообменник, металлопластиковые трубы). Во втором случае имеет место разрыв цепи, поэтому электроны никуда перетекать не смогут. Использование диэлектрических вставок — самый надежный способ предотвращения неконтролируемой миграции заряженных частиц.
И еще одно замечание, касающееся направления движения электролита: реакция пойдет лишь в случае, если анод расположен «ниже по течению» относительно катода (медный фитинг на входе в алюминиевый радиатор). Правда, если будут моменты простоя системы без движения теплоносителя, это замечание значения не имеет.
Алюминий обладает большей способностью отдавать электроны по сравнению с медью, что видно из значений их стандартных электродных потенциалов (–1,66 и +0,34 соответственно). Следовательно, в случае замкнутой цепи медь является катодом, а алюминий — анодом (рис. 3). Ионы алюминия Al3+ из кристаллической решетки переходят в раствор, образуя вместе с гидроксидионами OH– гидроксид алюминия Al(OH)3, а электроны поступают в медь. Оторванные от воды потерявшие электрон ионы водорода H+ используют их для объединения в молекулу H2. Коррозия алюминия продолжается, т.к. электроны непрерывно уходят из него, смещая тем самым равновесие в сторону образования ионов. Ход электрохимического процесса определяется разностью потенциалов элемента. Для пары «медь–алюминий» разность потенциалов составляет 2 В. Если взять пару «цинк–алюминий», то разность будет менее значительной — 0,9 В, а, значит, реакция пойдет в два раза медленнее.
Подведем итоги
Если при проектировании и монтаже будут приняты меры по предотвращению описанных выше процессов, алюминиевые радиаторы отлично прослужат десятки лет. Изолирующие диэлектрические вставки и контроль состава теплоносителя позволят заказчику наслаждаться отопительным прибором с множеством положительных характеристик: высокая теплоотдача, пластичность (т.е. устойчивость к гидроударам), небольшой вес, возможность легко изменять мощность путем добавления или удаления секций и пр.
>>> Также читайте по теме Алюминиевые радиаторы для высотных зданий России в журнале СОК 2002 №12
























