
Анализ существующих схем подготовки воды для заливки льда приводит к следующему выводу: чем ниже солесодержание воды и концентрация содержащихся в ней газов, тем выше качество получаемого льда. Для этих целей повсеместно применяется технология обратноосмотического обессоливания воды. Допустимо для заливки льда использовать пресную воду, то есть воду с солесодержанием до 1000 мг/л, но обязательно прошедшую предварительное осветление и умягчение. Системы дегазации необходимо применять в любом случае. Давайте разберёмся, почему должны выполняться вышеприведённые условия для получения качественного льда.
Вода — это совокупность одинаковых молекул (H2O), связанных определённым образом. Связь между молекулами воды определяется магнитным моментом каждой молекулы воды. Молекула кислорода имеет небольшой поверхностный отрицательный заряд, а две молекулы водорода — небольшой положительный заряд. Это происходит из-за того, что, хотя двухвалентный кислород присоединяет два одновалентных водорода (и тем самым полностью компенсируется сила ковалентной взаимосвязи), ещё остаётся нескомпенсированной электроотрицательность данных элементов. «Электроотрицательность» — это способность (сила) атомов химических элементов притягивать к себе электроны. Электроотрицательность кислорода (3,44) больше, чем водорода (2,2). Поэтому кислород старается притянуть к себе общие с водородом электроны с большей силой, чем водород. Очевидно, что кислороду в молекуле воды без разницы, какие электроны притягивать, «своего» водорода или «чужого». В результате одна молекула воды притягивается к другой. Однако притяжение между молекулами воды значительно меньше, чем сила притяжения ковалентной связи внутри молекулы воды. Поэтому и возникает непрерывная известная всем своей жидкой формой вода.
В результате молекула воды H2O проявляет физическое и химическое взаимодействие. Физическое взаимодействие обусловлено сильными дипольными (магнитными) свойствами молекулы воды. Химическое взаимодействие обусловлено тем, что молекула воды, собственно говоря, является неорганическим химическим соединением. Это говорит о том, что в воде происходят физико-химические процессы.


На рис. 1 представлен процесс растворения в воде поваренной соли (NaCl). В «сухом» состоянии поваренная соль имеет твёрдую кристаллическую форму. Но, если добавить воду, то начнётся процесс диссоциации (растворения) соли в воде. Происходит следующее. Имеющие небольшой поверхностный заряд молекулы воды начинают взаимодействовать с молекулами NaCl. Нужно понимать, что с солью взаимодействуют не только близлежащие молекулы воды, а вообще все молекулы воды в объёме, в котором происходит растворение. Это как перетягивать канат со слоном. Если против слона один или несколько человек, то слон выиграет. Но если против слона сто человек, то слон, скорее всего, уступит. Так и в воде. Взаимодействовать с молекулой NaCl будут одновременно все имеющиеся молекулы воды. Несмотря на то, что ковалентная связь в молекуле NaCl значительно сильнее, чем поверхностная связь молекул воды, тем не менее, общими усилиями молекулы воды могут компенсировать часть ковалентной связи молекулы поваренной соли.
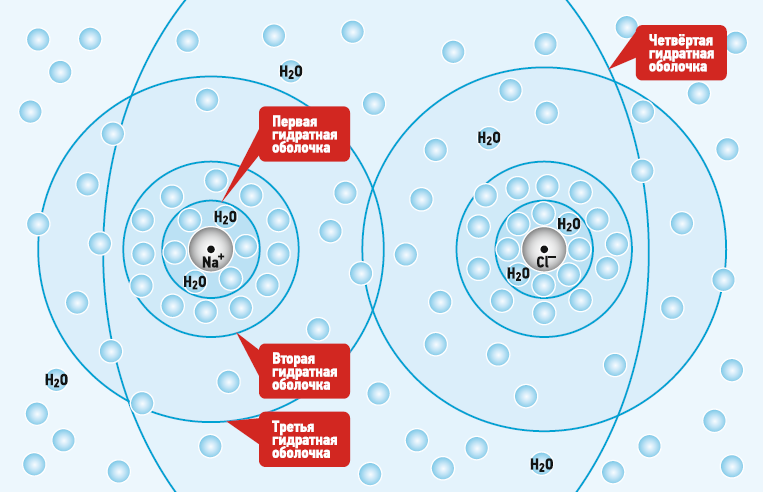
Рис. 1. Процесс растворения в воде поваренной соли (NaCl)
В итоге соль диссоциирует в объёме молекул воды на два иона — катион натрия Na+, заряжённый положительно, и анион хлора Cl-, заряжённый отрицательно. Ионы постоянно сохраняют силу притяжения между собой, но при этом часть этой силы компенсируют молекулы воды. Поэтому ионы приобретают способность отдельно (не в паре) перемещаться по всему объёму воды, обеспечивая при этом равновесное состояние всего объёма воды. Таким образом, ионы NaCl определённым образом «структурируют» молекулы воды вокруг себя.
На рис. 1 схематично показано, как происходит ориентирование молекул воды вокруг катиона Na+ и аниона Cl-. Очевидно, что близлежащие молекулы воды будут находиться в наибольшем «зацеплении» с ионами по сравнению с остальными молекулами воды. Близлежащие к иону молекулы воды образуют так называемую «первичную гидратную оболочку». Молекулы воды в этой оболочке довольно жёстко связаны с ионом и имеют некую льдоподобную структуру. Чем дальше от иона, тем меньше сила притяжения молекул воды к иону. Поэтому следующие гидратные оболочки всё меньше и меньше связаны с ионом. Но, тем не менее, они связаны. Все молекулы воды объёма, в котором растворена поваренная соль, участвуют во взаимодействии.
Явно выделяют ещё «вторичную» гидратную оболочку. Тем не менее, все молекулы воды участвуют в растворении. Поэтому можно говорит о третьей, четвертой и т. д. гидратных оболочках, как о способе формирования молекул воды вокруг иона. Или, точнее, надо говорить не о «третичных» и последующих гидратных оболочках, а о некоем градиенте силы воздействия молекул воды на конкретный ион. Чем дальше молекула воды от иона, тем меньше она с ним связана.
На рис. 1 также видно, как гидратные оболочки катиона могут накладываться на гидратные оболочки аниона. Поваренная соль находится в растворённом состоянии. Если измерить электропроводность данного объёма воды, то она будет одинакова во всех точках данного объёма. Это говорит о том, что катион и анион находятся одновременно в каждой точке данного объёма воды. Что, в свою очередь, говорит о стремлении молекул воды обеспечить некое равновесное состояние, о попытке полностью компенсировать заряд ионов, обеспечивая его равномерное распределение в своём объёме. Если объёма (количества молекул) воды недостаточно, то диссоциации кристалла соли на ионы не происходит. Эта способность определяется такой характеристикой соли, как растворимость. Например, в 1 кг воды при 25°C невозможно растворить более 0,35 кг поваренной соли.
Теперь вернёмся к воде для заливки льда. Очевидно, что чем однороднее структура кристаллов льда, тем прочнее лёд. Различные посторонние включения разрушают однородность льда и ухудшают его рабочие характеристики. Включениями могут быть твёрдые механические частицы или взвешенные вещества, органические кислоты и коллоидные примеси, неорганические химические соединения и растворённые в воде газы.
Для удаления взвешенных веществ можно применить фильтрацию, начиная от насыпных песчаных фильтров и заканчивая полипропиленовыми фильтрами с рейтингом до 1 мкм. Для удаления коллоидных примесей и органических кислот можно применять коагуляцию воды с последующим фильтрованием. На неорганических соединениях следует остановиться подробнее.
Неорганические соединения в воде содержатся в виде ионов. При замерзании воды количество активных «жидких» молекул воды становится меньше, и постепенно достигается предел растворимости для конкретной соли, присутствующей в воде. В результате во льду не существует ионов, там существуют твёрдые кристаллические соединения соли, которые в жидкой воде существовали в виде катионов и анионов. Неравномерность замерзания приведёт к тому, что сгустки кристаллов соли будут концентрироваться конкретно в том месте, где дольше всех оставалось состояние жидкой воды. Поэтому такой лёд будет неравномерным и, соответственно, относительно хрупким. Если вода для заливки льда изначально была пресная, то содержание соли в ней относительно невелико, и для многих целей такая вода вполне допустима. Однако есть одно существенное «но». Когда замёрзший лёд под действием приложенных к нему сил начинает таять в виде тонкой плёнки, то соли натрия вида NaCl, Na2SO4, NaHCO3 сразу переходят в растворённое состояние, не вызывая твёрдых образований на поверхности льда. Соли Сa(HCO3)2 и СaSO4, перейдя в твёрдое состояние в процессе заморозки льда, так и останутся в твёрдом состоянии при обратном оттаивании, при этом значительно ухудшая характеристики поверхности льда. Поэтому воду для заливки льда необходимо подвергать Na-катионированию. В результате в воде все двухи трёхвалентные катионы будут замещены на одновалентные легкорастворимые катионы натрия. Для получения льда высокого качества используют системы обратноосмотического обессоливания воды. Данные системы до 99% уменьшают минерализацию воды, тем самым позволяя получить однородный, без каких-либо включений лёд.

Остаётся ещё один вопрос. Как из воды удалить все присутствующие в ней газы? При замерзании пузырьки газа значительно увеличат хрупкость льда, разрушая его однородность. Если говорить о поверхностном, не загрязнённом источнике водоснабжения, имеющим постоянный контакт с атмосферой, то в воде такого источника обычно содержатся три газа: кислород, диоксид углерода и азот. При нормальном атмосферном давлении и температуре +20°C в дистиллированной воде содержится 9 мг/л кислорода, 14,8 мг/л азота и 0,5 мг/л диоксида углерода.
Для реальных поверхностных источников водоснабжения содержание кислорода будет несколько меньше, а диоксида углерода — больше из-за постоянно идущих процессов окисления органического вещества. Для подземных источников, не имеющих контакта с атмосферой, в воде может присутствовать сероводород или аммиак, что потребует предварительной специфической водоподготовки.
Удалить из воды кислород и диоксид углерода можно химическим способам. Для этого в подготовленную воду (прошедшую как минимум умягчение и, как дополнение, осмос) дозируют каустик (щёлочь) и бисульфит натрия (NaHSO3). Каустик свяжет углекислый газ в бикарбонат натрия (NaHCO3), а бисульфит натрия свяжет кислород в сульфат натрия (Na2SO4).
Но что делать с азотом? Необходимо отметить, что химические методы связывания растворённых газов значительно увеличивают итоговое солесодержание воды. Например, для удаления 1 мг/л кислорода требуется 7 мг/л бисульфита натрия. В результате, если в воде содержится 8 мг/л кислорода, то общее солесодержание воды после химической деаэрации вырастет на 7×8 = 56 мг/л. Это обстоятельство обесценивает применение обратного осмоса. Поэтому для целей полной дегазации лучше использовать два метода: термический метод или абсорбцию газов через мембранный контактор. В первом случае нагрев воды в виде тонкой плёнки до 100°C обеспечит полную дегазацию воды. Очевидно, что данный метод довольно сложный и затратный, применительно для целей заливки льда. Дегазированную воду надо хранить без контакта с атмосферой, при этом снижая её температуру до технологических параметров заливки льда.

Применение мембранного контактора «газ — жидкость», работающего в вакуумном режиме, позволяет удалить из воды все растворённые газы. Чем ниже вакуум, тем ниже остаточная концентрация газов в обработанной воде. Здесь следует обратить внимание на то, что если дегазировать не умягчённую воду, то карбонат кальция будет активно осаживаться в процессе дегазации воды в виде тонкой, твёрдой и нерастворимой в воде плёнки.
Современные технологии подготовки воды позволяют получать воду очень высокого качества на компактных полностью автоматизированных установках, не требующих постоянного обслуживающего персонала, и обеспечить наибольшую эффективность эксплуатации как самой установки водоподготовки, так и всего производственного комплекса в целом.

























