Известно, что железо в воде существует в двухи трёхвалентной формах. Трёхвалентная форма железа выпадает в осадок, то есть переходит из жидкой в твёрдую фазу и выходит из электромагнитного взаимодействия с молекулами воды. До тех пор, пока железо в воде в двухвалентной форме, оно растворено в воде в виде катиона железа и участвует в переносе электронов, то есть вносит свой вклад в электропроводность воды.
В природной воде двухвалентное растворённое железо существует в виде бикарбоната, хлорида и сульфата железа (если рассматривать только основные анионы). Причём непосредственно в воде будет наблюдаться равномерно распределённая концентрация каждого вида железа в мг-экв/л [1]. Но переход железа в трёхвалентное состояние и выпадение в осадок будет определяться непосредственно бикарбонатом и окислительно-восстановительным потенциалом воды.
Можно ли записать полноценное уравнение химической реакции образования трёхвалентного железа?
Вероятней всего нет. В специализированной литературе встречаются разные формы записи. К примеру [2]:
4Fe + O2 + 8HCO3 + 2H2O = 4Fe(OH)3осадок + 8CO2удаление. (1)
Формально это уравнение верно. Но давайте посмотрим на диаграмму Пурбе для железа (рис. 1).
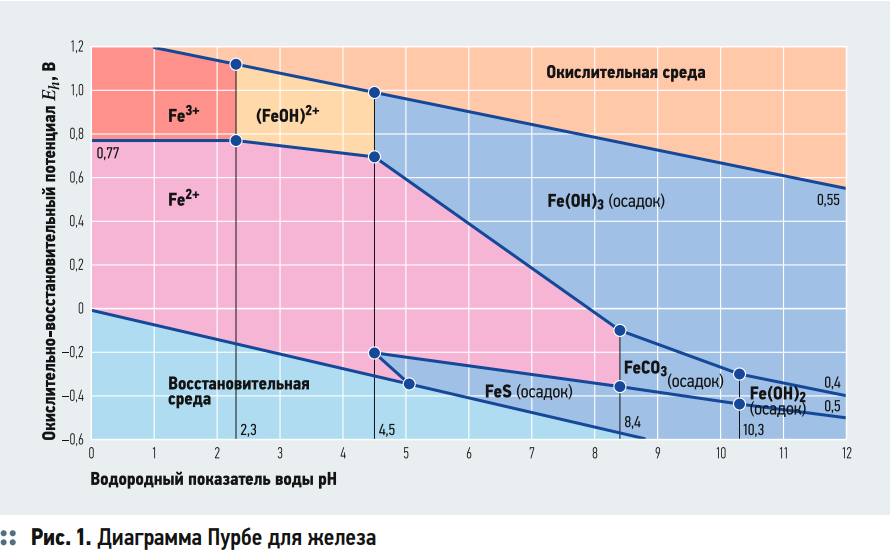
Диаграмма определяет границы существования в воде двухи трёхвалентного железа. На диаграмме отдельно выделяется значение рН = 8,4. При данном значении рН в воде начинает появляться гидроксид-ион (ОН) в результате гидролиза бикарбонатов:
HCO3 + H2O = OH + H2CO3 = OH + H2O + CO2.
Углекислота, которая выделяется в процессе гидролиза бикарбонатов, удаляется или нейтрализуется щёлочью. Таким образом, в воде присутствует гидрат, и даже при отсутствии в воде кислорода (ОВП воды отрицателен) железо из двухвалентной формы переходит в трёхвалентную и начинает выпадать в осадок.
Получается, что уравнение (1) не совсем корректно отражает процесс образования трёхвалентного гидроксида железа.
Можно сказать, что положительный ОВП воды окисляет двухвалентное железо в трёхвалентное, но выпадает в осадок трёхвалентное железо только при условии присутствия в воде гидрата (ОН). При этом, если в воде сразу присутствует гидрат, то для процесса образования трёхвалентного гидрата железа не требуется окислитель. Если в воде нет гидрата, но достаточно окислителя, то процесс окисления железа будет инициировать процесс гидролиза бикарбонатов с образованием гидрата и углекислоты. Гидрат железа выйдет из жидкой фазы (выпадает в осадок), а углекислота останется, и если её не отогнать или не нейтрализовать, то рН воды упадёт. Поэтому, чем больше в воде окислителя (газообразный кислород, атомарный кислород), тем меньше может быть рН воды для протекания процесса гидролиза бикарбонатов с получением требуемого для трёхвалентного железа гидрата. Если посмотреть на диаграмму Пурбе, то можно определить, что при значении рН менее 4,5 в воде не образуется трёхвалентного гидрата железа в виде осадка. Существует только растворённое железо, причём как двух-, так и трёхвалентное. При значении рН менее 4,5 гидрат не может быть получен из процесса гидролиза бикарбонатов, так как бикарбонаты полностью переходят в углекислоту, и в воде возможно существование только сильных кислот, которые в процессе диссоциации не вызывают образование гидрата.
Процесс окисления железа инициирует протекание процесса гидролиза бикарбонатов. При наличии в воде гидрата не требуется наличие в воде окислителя для формирования трёхвалентного гидрата железа. Необходимо учесть, что в процессе выпадения трёхвалентного железа в осадок значение рН воды и значение ОВП будут уменьшаться, и это будет требовать отгонки углекислоты либо её нейтрализацию щёлочью, а также поддержание достаточного количества окислителя. То есть будет требоваться постоянное поддержание требуемого значения рН и (или) ОВП для выпадения железа в осадок полностью.
Пример. В обескислороженную и обессоленную воду добавили некоторое количество хлорида железа и довели рН воды до значения 8,4 едким натром. При этом ОВП такой воды будет находиться чуть ниже нуля. Предположим, что ОВП будет постоянно около нуля. В любом случае перевод двухвалентного железа в осадок будет приближать ОВП к значению ноль со стороны отрицательных значений. Начнётся процесс образования трёхвалентного гидрата железа. Чем больше железа будет переходить в трёхвалентную форму, тем меньше становится рН воды. Гидрат выпадает в осадок с железом. Если посмотреть на диаграмму Пурбе, то обнаружим, что при значении ОВП, равным нулю, и рН = 8,4 в воде должна присутствовать только трёхвалентная форма в виде твёрдой фазы. Но в процессе выпадения железа рН воды падает и приходит в точку равновесия. На диаграмме это будет точка пересечения графика с осью абсцисс — этой точке будет соответствовать рН = 7,9 и ОВП = 0. Достигнув этой точки процесс выпадения железа в осадок прекратится. Будет достигнуто равновесие двухвалентного железа с значением рН и ОВП. При этом в воде мы будем наблюдать как двухвалентное железо, так и трёхвалентное. Конечно, трёхвалентное железо будет находиться в твёрдой фазе, но для того, чтобы выделить его из воды, потребуются определённые усилия в виде фильтрации через каталитические загрузки. Данный процесс сам по себе довольно сложный.
Если в воде содержалось большое количество железа, то часть его выпадет в осадок в процессе простого отстаивания (из-за образования взвеси тяжелее воды). Но для небольших содержаний железа до 1–2 мг/л будет требоваться специальное фильтрование. Поэтому в воде будет присутствовать как двух-, так и трёхвалентное железо, независимо от того, какие параметры данная вода имеет в текущий момент времени по рН и ОВП.
Итак, для удаления железа из воды следует придерживаться рекомендаций:
1. После полного удаления железа из исходной воды с повышенным содержанием железа точка пересечения, найденная по значениям ОВП и рН очищенной воды, должна находиться в области осадка (трёхвалентного гидрата железа). Внимание — точка пересечения не для исходной воды, а для очищенной!
2. Чем дальше точка пересечения очищенной воды по ОВП и рН находится от границы перехода двухвалентного железа в трёхвалентное в сторону осадка, тем меньше будет требоваться времени для полного окисления железа.
3. Окислению железа и последующему выпадению в осадок мешает ряд факторов — прежде всего наличие органического вещества и кремния в воде.
Рассмотрим немного подробнее последнее условие. Диаграмма Пурбе не учитывает некоторые факторы, которые замедляют или полностью прекращают процесс окисления железа.
В природной поверхностной воде всё время будет наблюдаться повышенное значение окисляемости из-за постоянного контакта с поверхностными стоками, кислородом и т. п. Окисляемость в воде в основном представлена гуминовыми кислотами. Гуминовые кислоты образуют довольно прочные соединения с ионами растворённого железа. Такое железо принято называть железом в органической форме. Данное железо довольно плохо окисляется кислородом воздуха из-за своей связи с органикой. Соответственно, такое железо не может быть отфильтровано на традиционных обезжелезивающих материалах. Можно использовать активированный уголь, но это дорого и скорее всего не приведёт к требуемому результату — всего лишь немного уменьшит содержание органического железа, как следствие удаления органики на угле. Для окисления органического железа требуется окислить органику до приемлемых значений. Считается, что при значении окисляемости воды выше 4,0 мг/л в воде начинает появляться органическое железо. Чем выше значение органики, тем больше железа наблюдается в органической форме. Для окисления органики и, соответственно, железа в данном случае необходимо использовать атомарный кислород (хлор, гипохлорит натрия, озон). Окисление органики и железа будет происходить полноценнее при увеличении рН обрабатываемой воды. Также для удаления органического железа можно использовать коагуляцию. Но данная технология требует довольно серьёзного химического контроля, а также дополнительных реагентов, если температура обрабатываемой воды будет ниже 20°C. Но при высоком содержании органики в любом случае будет требоваться коагуляция. Можно сказать, что для небольших полностью автоматизированных установок очистки воды от железа дозирование гипохлорита натрия для целей окисления железа и, возможно, небольшого количества органики — это способ сделать установку водоподготовки более компактной и надёжной. Также дозирование гипохлорита вместо аэрации удобно применять для целей предподготовки воды перед установками обратного осмоса.
Кремний в воде также оказывает тормозящее воздействие на процесс окисления железа. Кремний в воде образует различные формы кремниевых кислот, которые, в свою очередь, образуют устойчивые коллоидные растворы. Кремниевые кислоты малорастворимы в воде. Данное коллоидное образование существенно тормозит процесс окисления и фильтрования железа.
Приведём пример из практики. Исходная вода — артезианская (окисляемость не более 1,0 мг/л, исходное содержание железа — 1,8 мг/л). При значении кремния в воде до 3,0 мг/л фактически не наблюдается сложности с удалением из артезианской воды железа при помощи аэрации и последующей фильтрации.
Похожий случай. Артезианская вода (исходное содержании железа — 1,1 мг/л, кремния — 9,8–10,2 мг/л). Для окисления железа использовался воздух и затем перманганат калия. После окисления и фильтрации не удавалось получить требуемое значение железа в воде (менее 0,1 мг/л) даже при минимальных расходах воды.
На «чистой» загрузке удавалось получить значения железа 0,15–0,3 мг/л, но после нескольких недель. Значение железа в очищенной воде вырастало до 0,5 мг/л, и данное повышенное значение держалось постоянно. Осмотр загрузки показывал её полное загрязнение структурой, похожей на гель (и это в условиях ежедневной полноценной промывки фильтров). Вероятно, гель ослаблял каталитические свойства загрузки. Удовлетворительный результат по железу удалось получить только после того, как время контакта воды и загрузки было увеличено в два раза.
Ещё стоит сказать, что двухвалентное железо можно удалять при помощи процесса катионирования. При устойчивых низких значениях рН воды можно использовать либо Н-, либо Na-катионирование для удаления железа. Однако в этом случае будет существенно изменён ионный состав воды.


























