Аэрация занимает важное место среди методов водоподготовки для хозяйственно-питьевых и технических нужд. В работе [1] указывается, например, что аэрирование позволяет удалить из поверхностных вод газообразные и летучие органические соединения, нефтепродукты, взвеси с плотностью менее 1000 кг/м3, позволяет повысить содержание кислорода. При обработке подземных вод аэрация используется, прежде всего, в процессах обезжелезивания воды. В ряде работ, посвящённых процессу обезжелезивания, отмечается также необходимость попутного удаления избытка углекислоты, что достигается в процессе аэрации с помощью различных приёмов — упрощённой аэрацией, применением вакуумно-эжекционных аппаратов, барботированием с помощью компрессоров (воздуходувок) и т.п.
Также отмечается, что одновременно с удалением избытка углекислоты происходит повышение величины рН. Из описания различных способов обезжелезивания подземных вод нетрудно сделать вывод, что основное внимание уделяется оценке окислительной способности того или иного метода. По возрастанию величины окислительной способности эти методы можно условно разместить в виде следующего ряда:
- упрощённая аэрация и одноступенчатая фильтрация;
- упрощённая аэрация и двухступенчатая фильтрация;
- усиленная аэрация через гидростатический смеситель (с использованием для подачи воздуха эжектора или компрессора) и фильтрация;
- усиленная аэрация с применением барботажного бассейна и фильтрация;
- усиленная аэрация с применением брызгального бассейна и фильтрация;
- усиленная аэрация с применением градирни и фильтрация;
- вакуумно-эжекционная аэрация и фильтрация.
Возможно использование для целей обезжелезивания сооружений, аналогичных биофильтрам систем очистки сточных вод [2], но оценить их окислительную способность пока затруднительно.
Иные методы безреагентного обезжелезивания являются разновидностями вышеперечисленных. Все они выполнены по одной схеме: сначала аэрационное устройство или сооружение, затем устройство или сооружение для отделения от обрабатываемой из воды продуктов окисления — как правило, скорые фильтры той или иной конструкции. В некоторых случаях, когда в воде присутствует только трёхвалентное железо в виде взвеси, достаточно бывает простого отстаивания или механической фильтрации на фильтрах с размером пор менее 5 мкм [3].
Очевидно, что окисление двухвалентного железа Fe2+ происходит не только в аэрационном сооружении, но и в слое фильтрующей загрузки. В последнем случае физико-химические реакции протекают в пористой среде на поверхности раздела фаз при воздействии движущегося потока воды. Для описания столь сложного процесса адекватной математической модели до сих пор не создано. Однако несомненно, что безреагентное обезжелезивание тем эффективнее, чем более эффективно работают аэрационные устройства и сооружения.
Иные методы безреагентного обезжелезивания являются разновидностями вышеперечисленных. Все они выполнены по одной схеме: сначала аэрационное устройство или сооружение, затем устройство или сооружение для отделения от обрабатываемой из воды продуктов окисления
Итак, использование аэрации применительно к процессу обезжелезивания обосновывают, прежде всего, необходимостью обогащения воды кислородом и удаления избытка углекислоты, что способствует первичному окислению железоорганических соединений и повышению рН (примечательно, что такая формулировка слово в слово встречается в работах разных авторов). При этом не раскрывается, каким образом удаление углекислоты способствует повышению рН и каковы граничные условия для данного процесса. На то, что определённые ограничения для процесса аэрации существуют, имеются указания в некоторых литературных источниках. Например, в [4] в главе 17 («Окисление и обеззараживание») отмечается, что «насыщение воды воздухом в целях окисления может привести к существенным и нежелательным изменениям её кальций-углеродного равновесия, так как отдувка CO2 придаёт воде инкрустирующий характер и может приводить к выпадению в осадок карбоната кальция». Но и здесь авторы не показывают, почему выделение углекислого газа из обрабатываемой воды приводит к таким изменениям в поведении системы.
На неоднозначность последствий контакта обрабатываемой воды и воздуха указывается в работах, посвящённых процессу умягчению. Так, в [5] приводятся данные наблюдений, что вода в открытых водоёмах, негерметичных ёмкостях и градирнях способна снижать рН до 6,3 за счёт растворения CO2.
Эти кажущиеся на первый взгляд несоответствия вполне могут быть разрешены при рассмотрении углекислотного равновесия в воде, которое по сути своей является проявлением буферных свойств среды — в данном случае в виде так называемого «гидрокарбонатного буфера».
Следует сказать несколько слов о теории буферных растворов Хендерсона-Хассельбаха, разработанной ещё в начале XX века. Как известно, диссоциация кислот происходит по схеме:

где Н+ — катион водорода, который фактически является протоном; Аc- анион, кислотный остаток.
Равновесие между молекулами НАс и ионами Н+ и Ас- выражается константой диссоциации:

Константа диссоциации (которая является разновидностью константы химического равновесия) зависит от природы электролита и растворителя и от температуры, но не зависит от концентрации раствора. Чем ниже значение Кд, тем более слабой считается кислота. Слабые кислоты имеют Кд менее 10-3 — иными словами, в растворе слабой кислоты относительно велико содержание молекул [НАс]. Данное обстоятельство и обуславливает способность буферных систем в известной степени поддерживать постоянное значение активной реакции воды рН: при добавлении некоторого количества сильного основания ионы OH- вступают в реакцию с ионами H+ с образованием молекул воды, что вызывает с одной стороны снижение концентрации [H+] и, с другой стороны, вызывает дальнейшую диссоциацию молекул кислоты НАс (чтобы сохранялось равновесие согласно формуле (2)).
Аналогично при добавлении в раствор сильной кислоты «посторонние» ионы H+ связываются с анионами Ас- с образованием молекул НАс, что препятствует росту концентрации [H+] и снижению рН, соответственно. Естественно, способность буферных растворов поддерживать постоянство рН не бесконечна и определяется так называемой буферной ёмкостью.
Константа диссоциации (которая является разновидностью константы химического равновесия) зависит от природы электролита и растворителя и от температуры, но не зависит от концентрации раствора. Чем ниже значение её значение, тем более слабой считается кислота
При рассмотрении буферных систем принята следующая терминология: молекулы кислоты НАс называют донорами протонов, а анионы Ас- — акцепторами протонов, подразумевая, что ионы водорода Н+ могут переходить от молекул кислоты к ионам кислотного остатка. Далее представим выражение (2) относительно концентрации ионов [Н+]:
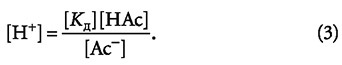
Записав выражение (3) для отрицательных десятичных логарифмов, получим следующее выражение:
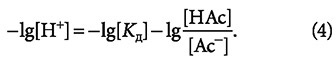
Левая часть выражения (4) представляет собой показатель рН, что позволяет переписать (4) в виде:
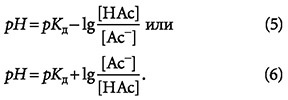
Как было сказано выше, Ас- являются акцепторами протонов, НАс — донорами протонов, поэтому:

Выражение (7) называется уравнением Хендерсона-Хассельбаха, опираясь на которое можно сделать ряд важных выводов. В принципе, любая слабая кислота (или её хорошо растворимая соль) могут являться буферным раствором. Опытным путём с помощью титрования щелочи или кислоты можно привести систему в такое состояние, когда в выражении (6) концентрация донора ионов [НАс] будет равна концентрации акцептора ионов [Ас-].
Тогда при равенстве концентраций [Ac-] и [HAc] значение рН раствора будет соответствовать отрицательному десятичному логарифму константы диссоциации Кд, то есть рН = рКд (обычно в литературе для обозначения рКд используется символ рК`).
Чем более сильной является кислота, тем выше значение рН в этом случае. Например, для ацетатного буфера (система CH3COOH-CH3COO-) рН = рКд = 4,76, фосфатного буфера (система H2PO - HPO2-4) рН = рКд = 6,86 и т.д.
Согласно уравнению (6), отклонение значения рН воды от равновесного определяется соотношением [Ас-] и [НАс]: если [Ас-] < [НАс], то рН < рКд, а если [Ас-] > [НАс], то рН > рКд.
Относительно природных вод следует отметить, что, несмотря на всё разнообразие, основными ионами, содержащимися в них, являются SO2-4, Cl-, CO2-3, HCO-3, Ca2+, Mg2+, Na+, иногда со значительными примесями Fe2+. Другие анионы и катионы содержатся в микроколичествах, существенно не влияющих на химическое равновесие.
Основным веществом, определяющим буферные свойства воды, в данном случае является угольная кислота H2CO3 и её производные — гидрокарбонат-ион HCO-3 и карбонат-ион CO2-3.
Диссоциация угольной кислоты происходит в две ступени и описывается уравнениями:
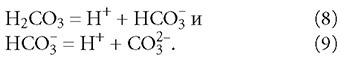
Угольная кислота весьма неустойчива и легко разлагается с образованием гидрата диоксида углерода [CO2·H2O], который, в свою очередь, разлагается на углекислый газ и воду. Учитывая, что константа равновесия:
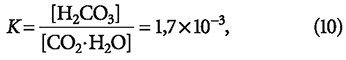
на долю молекул H2CO3 приходится менее 1 % от общего количества неорганических соединений углерода, то без ущерба для точности расчётов можно записать следующее:
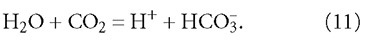
Несмотря на то, что в реакции участвует некоторое количество молекул воды, это почти не влияет на их концентрацию в растворе (молекул воды в растворе несоизмеримо больше, чем ионов), и константы диссоциации (равновесия) для обеих реакций равны:
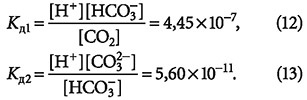
Нетрудно заметить, что буферными свойствами обладает гидрокарбонат-ион, имеющий возможность принимать или отдавать протон Н+.
Принимая, что рН = -lg[H+], а также рКд = -lg(KH), уравнение (6) для обеих стадий диссоциации угольной кислоты запишется в виде:
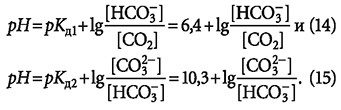
Обычно в литературе, посвящённой химии воды, приводят классические графики углекислотного равновесия в воде (рис. 1) с такого рода пояснениями: «в зависимости от значения рН воды меняется степень диссоциации угольной кислоты», «при рН = 3,7-4,0 вся находящаяся в воде углекислота представлена только диоксидом углерода CO2», «при дальнейшем повышении рН (более 8,4) свободного СО2 в воде нет, а только гидрокарбонат- и карбонат-ионы» и т.п.
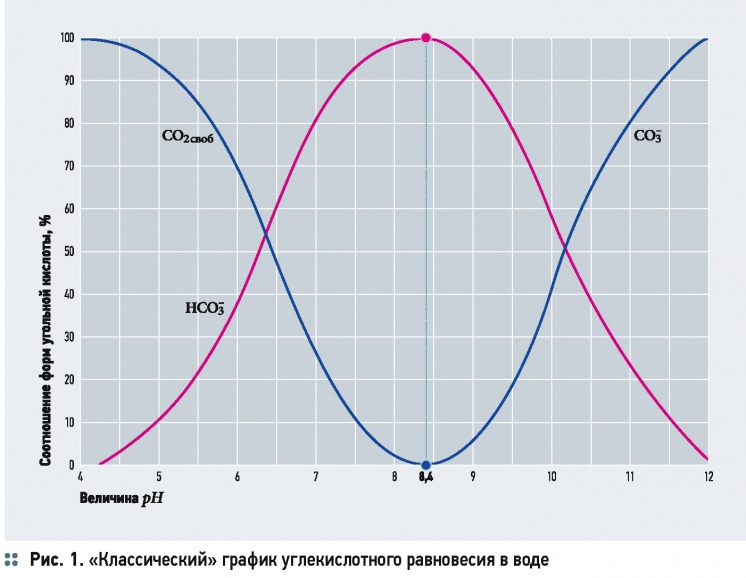
Это не вполне корректные утверждения, хотя сами по себе графики [CO2] = f(pH), [HCO-3] = f(pH) и [CO2-3] = f(pH) и дают довольно наглядное представление о состоянии системы. Согласно теории буферных растворов, во-первых, соотношение концентраций акцептора и донора протонов определяет значение рН, а не наоборот, во-вторых, не может возникнуть ситуации, когда концентрация одного из компонентов будет равна нулю: она может быть бесконечно малой, но в любом случае больше нуля.
Данные положения представляют теоретический интерес только на первый взгляд — в реальности они позволяют предложить более адекватные подходы для технологических расчётов.
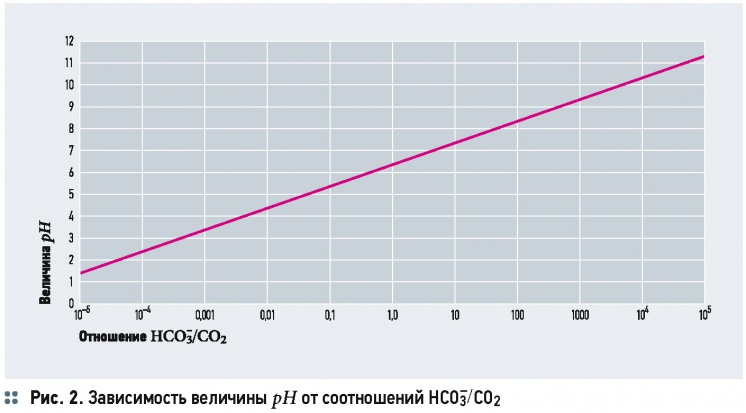
На рис. 2 показан график изменения рН согласно выражению (14). Аналогичный график можно построить и согласно выражению (15) — см. рис. 3. Очевидно, что данные графики могут отображаться в виде прямых только в логарифмических координатах по оси ОХ.
Следует сказать несколько слов и о таком показателе качества воды, как щёлочность. Под ним понимают концентрацию в воде анионов слабых кислот и гидроксильных ионов, которые вступают в реакцию с сильными кислотами, а точнее — с ионами Н+. Применительно к природной воде обычно выделяют гидрокарбонатную, карбонатную и гидратную щёлочность.
То обстоятельство, что для природной воды не учитываются иные виды щёлочности (силикатная, гуматная, фосфатная и т.п.), образованные другими слабыми кислотами, помимо угольной, указывает, что в случае природных вод мы имеем дело с гидрокарбонатным буферным раствором, подчиняющимся уравнению Хендерсона-Хассельбаха. Правда, об этом почти никто из авторов учебников по химии воды не упоминает. К слову, в промышленных сточных водах сложного состава может быть заметно влияние и иных буферных систем помимо гидрокарбонатной. Не исключено, что в природных водах из поверхностных источников следует учитывать также влияние гуматного буфера.
Согласно теории буферных растворов, во-первых, соотношение концентраций акцептора и донора протонов определяет значение рН, а не наоборот, во-вторых, не может возникнуть ситуации, когда концентрация одного из компонентов будет равна нулю: она может быть бесконечно малой, но в любом случае больше нуля
Часто в литературе при описании показателя щёлочности делают следующую приписку, что при рН > 8,5 возникает гидратная щёлочность, обусловленная концентрацией в воде гидроксильных ионов OH-.
При этом возникает логичный вопрос: разве гидроксид-ионы не присутствуют в воде при других значениях рН ? Тогда какой смысл в выделении показателя гидратной щёлочности?
Примечательно, что в [6] выделяют несколько иные виды щёлочности:
- общая щёлочность Ат (щёлочность, определяемая титрованием пробы воды до значения рН = 4,5);
- свободная щёлочность Ар (щёлочность, определяемая титрованием пробы воды до значения рН = 8,3);
- карбонатная щёлочность (щёлочность, определяемая титрованием пробы воды до значения рН = 5,4).
Титрование производится раствором соляной кислоты.
Логика выделения границ между различными видами щёлочности становится понятной, если проследить изменение отношения [HCO-3]/[CO2] в выражении (14) при рН = 4,5; 5,4 и 8,3, а также особенности изменения цвета кислотноосновных индикаторных растворов, используемых при проведении анализов качества воды.
Как уже говорилось выше, буферные системы способны существенно замедлять изменение значений рН растворов при добавлении в них кислот или оснований. При этом буферная ёмкость, конечно, ограничена. Но границы, в которых продукты диссоциации слабых кислот оказывают своё стабилизирующее действие (в данном случае нас интересует анион HCO-3), в общем, довольно субъективны.
Ведь (и на этом также акцентировалось внимание) в растворе одновременно присутствуют все вещества, участвующие в реакциях (8), (9) и (11). Классическим определением буферной ёмкости раствора является количество сильной кислоты или основания [моль/л], способное изменить показание рН на единицу выше или ниже значения рН = рКд. То есть для гидрокарбонатного буфера (рН = рКд = 6,4) буферная ёмкость ограничена значениями рН от 5,4 до 7,4.
С другой стороны, можно зафиксировать точки, где отношение компонентов системы будет отличаться на два порядка, то есть:
[HCO-3]/[CO2] = 0,01 и [CO2-3]/[HCO-3] = 0,01.
Тогда, согласно выражению (14), рН составит 4,4 и, согласно выражению (15), рН будет равно 8,3.
Переход окраски индикатора фенолфталеина с бесцветной на розовую происходит при рН = 8,2-8,3, поэтому отсутствие розовой окраски у смеси испытываемой воды и фенолфталеина показывает, что свободная щёлочность воды, согласно [6], равна нулю. Достижение рН = 5,4 при титровании исследуемой воды соляной кислотой контролируют с помощью электродов рН-метра.
Смесь индикаторов бромкрезолового зелёного и метилового красного меняет окраску с сине-зелёной на серую при рН = 4,5 — это, согласно широко распространённому мнению, является показателем того, что углекислота представле на только углекислым газом CO2 и молекулами H2CO3.
Очевидно, классификация видов щёлочности объясняется устоявшейся традицией и удобством проведения анализов. Ведь на самом деле в буферном растворе одновременно присутствуют все вещества, участвующие в реакции, а при возрастании рН свыше 8,3 (или 8,5, согласно мнению других авторов) никакой новой разновидности щёлочности (свободной или гидратной), конечно, не образуется. Более того, использование термина «растворенная углекислота» скорее затрудняет понимание вопроса, так как не вполне понятно, что имеется в виду: молекулярная H2CO3, растворённый углекислый газ, гидрокарбонаты или карбонаты. В этой связи широко используемое понятие «удаление части растворённой углекислоты» в процессе аэрации представляется более чем спорным. Так называемую «гидратную щёлочность» (которая соответствует концентрации ионов ОН-) можно оценить по выражению:
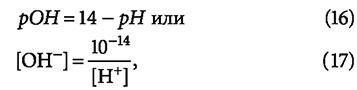
причём концентрации [OH-] и [H+] берутся в [моль/л].
Следует заметить, что обычно общая щёлочность природных вод находится в пределах 10-3-10-2 моль/л. Концентрация же ионов OH- даже при значении рН = 9 (что встречается очень редко) составляет всего 10-5 моль/л, что на два-три порядка меньше. Следовательно, для практических расчётов можно принять показатель общей щёлочности, определяемый лабораториями при анализах качества воды, равным сумме концентраций ионов HCO-3 и CO2-3.
Таким образом, уравнения (14) и (15) позволяют оценить состояние углекислотного равновесия, в том числе определить возможное изменение показателя рН в процессе аэрации. Однако предпочтительней в расчётах использовать выражение (14), что и будет показано далее.
Классификация видов щёлочности объясняется устоявшейся традицией и удобством проведения анализов

Выводы
1. Природные воды, в особенности подземные, используемые для целей водоснабжения, допустимо рассматривать как гидрокарбонатный буферный раствор, подчиняющийся уравнению Хендерсо-на-Хассельбаха.
2. Значение рН воды определяется соотношением концентраций составляющих буферного раствора — CO2, HCO-3, CO2-3. Весьма распространённое графическое представление углекислотного равновесия в воде в зависимости от рН (рис. 1) имеет лишь справочное значение и не может быть использовано при технологических расчётах.
3. Разделение понятий карбонатной/гидратной щёлочности условно и не отражает реальных химических процессов, происходящих в буферном растворе.

























